Angelehnt an die vorherigen Leitlinienversionen, wird eine Basisdiagnostik bei Frauen nach Eintritt der Menopause und bei Männern ab dem Alter von 50 Jahren in Abhängigkeit vom individuell vorliegenden Frakturrisikofaktorenprofil empfohlen. Diese Empfehlung ist an die SIGN-Empfehlungen adaptiert (SIGN revised Version Jan 202: 2.1 und 3.0-3.6), die besagt, dass ab dem Alter von 50 Jahren bei Auftreten verschiedenster Risikofaktoren eine Basisdiagnostik empfohlen werden sollte (SIGN). Ab diesem Alter ist es sinnvoll zu eruieren, ob Risikofaktoren für ein erhöhtes Frakturrisiko vorliegen. Im Kontext des Deutschen Gesundheitssystems bietet sich hierfür die Gesundheitsuntersuchung nach § 25 SGB V an sowie das geriatrische Assessment und bei Bekanntwerden von Risikofaktoren für Osteoporose-typische Frakturen oder wenn Personen bezüglich ihres Frakturrisikos eine Beratung wünschen.
Im Alter von 70 Jahren ist dann das Frakturrisiko bei Frauen so hoch (im DVO-Modell sind es durchschnittlich 3 %/3 Jahre für klinische Wirbelkörper- und Schenkelhalsfrakturen), dass eine Knochendichtemessung indiziert ist, sofern daraus spezifische therapeutische Konsequenzen abgeleitet werden sollen. Dies kann faktisch nur umgesetzt werden, wenn es in Deutschland flächendeckend ein genügendes vertragsärztliches Angebot für diese Untersuchung gibt.
Bei Hinweisen auf eine sekundäre Osteoporose oder auffälligen Werten der Knochendichtemessung bzw. nach vorausgegangener Fraktur ist die weitere Basisdiagnostik mit Laboruntersuchung (siehe Abschnitt 9.5.) und ggf. bildgebender Diagnostik (9.6.) indiziert.
Eine spezifische Frakturrisikoschwelle zur Basisdiagnostik wird nicht aufrechterhalten. Aufgrund des geringen altersassoziierten Frakturrisikos in jüngeren Jahren und des eingeschränkten vertragsärztlichen Angebotes für Knochendichtemessungen sind insbesondere in der jungen Patientengruppe (50-60 Jahre) die als ärztlich relevant erachteten Risikofaktoren in der Indikationsstellung zur Osteoporose-Diagnostik zu beachten, um analog zu den bisherigen Empfehlungen ein Risikoadaptiertes Case Finding durchzuführen. In dieser Beurteilung sind, neben den nach Prävalenz und Risikohöhe priorisierten Risikofaktoren, das Alter der Patientinnen und Patienten sowie die klinische Gesamtsituation zu berücksichtigen.
Die jährliche Inzidenz von klinischen Wirbelkörper- oder hüftnahen Frakturen liegt bei Männern und Frauen bei durchschnittlich ca. 100/100.000 Personen. Bei einer zusätzlichen 3-fachen Erhöhung des Frakturrisikos aufgrund vorliegender Risikofaktorkonstellation(en) treten diese Frakturen in ca. 1 %/3 Jahren in dieser Altersgruppe neu auf.
Zur besseren Darstellung des absoluten Frakturrisikos für Hüft- und Wirbelkörperfrakturen in Abhängigkeit von Alter und Geschlecht folgende Grafik, an der das absolute Frakturrisiko für ein gegebenes Alter für Männer und Frauen in einer Population ohne vorliegende Frakturrisikofaktoren abgelesen werden kann (Glüer C et al. 2023 📖Glüer, Claus-C., Klaus Engelke, and Friederike Thomasius. “Das Konzept des DVO Frakturrisikorechners.” Osteologie (2023) im Paper Graphik zu Inzidenz von Hüft-oder Wirbelkörperfraktur in Deutschland).
Hinsichtlich der empfohlenen Osteoporose-Basisdiagnostik wird auf das Kapitel 8 verwiesen. Die Basisdiagnostik umfasst mehrere Untersuchungen, die je nach Ausgangs- und Untersuchungsbefund gestuft durchzuführen sind.
| Empfehlung | |
|
Eine Basisdiagnostik der Osteoporose sollte bei Vorliegen einer ärztlich als relevant erachteten Frakturrisikokonstellation bei postmenopausalen Frauen und bei Männern ab dem Alter von 50 Jahren empfohlen werden
|
Empfehlungsgrad B |
| Evidenzgrad Expertenkonsens |
|
| Konsensstärke 19/19 Starker Konsens |
|
| Leitlinienadaptation: SIGN (SIGN revised Version Jan 202: 2.1 und 3.0-3.6), analog zur Leitlinienempfehlung 2017 | |
Diese Empfehlung erfolgt i. S. einer Case Finding Strategie und unter Berücksichtigung von Alter und Geschlecht sowie vorliegender Risikofaktoren, die in einer systematischen Recherche zu Risikofaktoren für vertebrale Frakturen und Schenkelhalsfrakturen und unter Berücksichtigung der SIGN-Empfehlungen zur Diagnostik der Osteoporose untersucht wurden. Bei insgesamt 103 Risikofaktorenkandidatinnen und -kandidaten in erster Recherche erfolgte eine Priorisierung der Risikofaktoren nach Prävalenz und Risikogradienten. Die priorisierten ersten 32 Risikofaktoren werden in der ersten Version des Risikorechners berücksichtigt werden, sie wurden in einem Krankenkassendatensatz überprüft hinsichtlich Prävalenz und Frakturprädiktion, sodass neben dem Risikogradienten aus der Literatur, Risikogradienten im Krankenkassendatensatz in die Festlegung des Risikogradienten mit einfließen. Neben diesen 32 Risikofaktoren fließen Risikofaktoren in das Case Finding ein, die bereits in der letzten Version der Leitlinie Anwendung fanden und zur Indikationsstellung einer Basisdiagnostik dienten, nähere Ausführungen Kapitel 4 Risikofaktoren, jedoch nicht unter die 32 priorisierten Risikofaktoren fallen. Auch sie begründen die Indikation zur Basisdiagnostik. Diese Faktoren können als Frakturrisikoindikatoren angewendet werden, d. h. bei Vorliegen sollte eine Basisdiagnostik angedacht werden, sie fließen aber nicht in die (elektronische) Risikoberechnung ein.
Es ist anzumerken, dass Männer die Risikostufe später erreichen, wobei der Unterschied in Jahren nach derzeitigen Daten ca. 5 Jahre beträgt. Aus pragmatischen Gründen und im Wissen insbesondere der starken Unterdiagnostik der Osteoporose soll vorerst nicht weiter geschlechtsspezifisch differenziert werden, mit Vorliegen des Risikorechners ist eine Präzisierung vorgesehen.
Es werden auch nicht alle Risikofaktoren, die im Kapitel 4 Frakturrisikofaktoren näher beschrieben sind, in der Beurteilung des Frakturrisikos im Risikorechner berücksichtigt, dies wegen nicht ausreichender Studiendaten zum Beleg der Erhöhung des Frakturrisikos postmenopausal oder für vertebrale und Schenkelhalsfrakturen. Viele Studien belegen aber ein erhöht liegendes Frakturrisiko für „osteoporotische Frakturen“ oder „generell Frakturen“, bzw. eine Frakturrisikoerhöhung in jüngeren Alterskollektiven und/oder die Pathophysiologie der Erkrankung erklärt den negativen Effekt auf den Knochenstoffwechsel. Somit kann in den verschiedenen Risikokonstellationen, die auch im Kapitel Frakturrisikofaktoren hervorgehoben sind, eine Osteoporose-Basisdiagnostik vor dem Alter von 50 Jahren angeboten werden. Diese Konstellationen sind in der untenstehenden Tabelle mit einem Asterix (*) hervorgehoben.
| Empfehlung | |
|
In Abhängigkeit vom individuell vorliegenden Risikofaktorenprofil sollte eine Basisdiagnostik der Osteoporose auch Frauen und Männern <50 Jahre angeboten werden.
|
Empfehlungsgrad B |
| Evidenzgrad 2 analog zu Risikofaktorenbewertung |
|
| Konsensstärke 17 /17 Starker Konsens |
|
| Zusammenfassende Tabelle der Risikofaktoren, die zur Indikationsstellung für eine Basisdiagnostik berücksichtigt werden sollen * auch vor dem Alter von 50 Jahren |
Angabe zu relativem Risiko für vertebrale und Schenkelhalsfrakturen |
| Frakturvorgeschichte | |
| Hüftfraktur im letzten Jahr Hüftfraktur, Zeitabstand > 12 Monate |
4,1 2,5 |
| Wirbelkörperfraktur im letzten Jahr Wirbelkörperfraktur (en), Zeitabstand > 12 Monate: Anzahl = 1 Anzahl = 2 Anzahl >=3, mindestens eine Grad 2 Nur Grad 1 Genant Auch und max. Grad 2 Genant Auch Grad 3 |
2,9
2,0 |
| Humerusfraktur | 1,7 |
| Beckenfraktur | 1,7 |
| Unterarmfraktur | 1,6 |
| Jede Fraktur postmenopausal und beim Mann ab 60 Jahren mit Ausnahme von Finger-, Zehen- und Schädelfrakturen | Risikoindikator für Basisdiagnostik |
| Risikofaktoren aus der Endokrinologie | |
| Diabetes mellitus Typ 1 | 2,5 |
| Diabetes mellitus Typ 2 Seit 5-10 Jahren Seit > 10 Jahren |
1,1 1,6 |
| Primärer Hyperparathyreoidismus | 2,2 |
| Cushing-Syndrom und subklinischer Hyperkortisolismus |
Risikoindikatoren für
Basisdiagnostik |
| Wachstumshormonmangel bei Hypophyseninsuffizienz | |
| Männlicher Hypogonadismus durch Hormonablative Therapie | |
| männlicher Hypogonadismus anderer Ursache | |
| TSH Suppression 0,1 – 0,45 mU/l <0,1 mU/l |
1,2 1,2 |
| Risikofaktoren aus der Rheumatologie | |
| Spondylitis ankylosans/axiale Spondyloarthritis* | 1,6 |
| Zöliakie |
Risikoindikatoren für
Basisdiagnostik |
| Morbus Crohn* | |
| Colitis ulcerosa* | |
| Systemischer Lupus erythematodes* | |
| Rheumatoide Arthritis | 2,7 |
| Risikofaktoren aus der Neurologie/Geriatrie-Sturzrisiko assoziiert | |
| Schlaganfall | 1,6 |
| Multiple Sklerose | 2,1 |
| M. Parkinson | 1,7 |
| Epilepsie und Antikonvulsiva | 1,2 |
| Demenz/ M. Alzheimer | 1,6 |
| Depression/Antidepressiva | 1,3 |
| Chronische Hyponatriämie | 1,4 |
| Sturz in den vergangenen 12 Monaten >1 Sturz in den vergangenen 12 Monaten (1-Jahres RR) |
1,6 2,0 |
| Timed Up and Go Test > 12 Sek. | 1,8 |
| Allgemeine Risikofaktoren | |
| Body Mass Index BMI <= 15 kg/m2 15-18,5 kg/m2 18,5-< 20 kg/m2 |
2,2 1,7 1,3 |
| Alkoholkonsum >50 g/Tag | 1,9 |
| Rauchen aktuell oder COPD |
1,5 1,3 |
| Herzinsuffizienz, chronisch | 1,5 |
| Niereninsuffizienz ab CKD 3a,3b,4 | 1,6 |
| BII Magenresektion oder Gastrektomie |
Risikoindikator für
Basisdiagnostik |
| Bariatrische Operation* | |
| Monoklonale Gammopathie unklarer Signifikanz (MGUS) | 2 |
| HIV* | Risikoindikator für Basisdiagnostik |
| Vater oder Mutter mit Hüftbruch | 1,3 |
| Medikationen | |
| Protonenpumpenhemmer > 3 Monate | 1,4 |
| Opioide | 1,4 |
| Aromatasehemmer mit Beginn der Therapie* | Risikoindikator für Basisdiagnostik |
| Orale Glucocorticoide
Dosis < 2,5 mg Prednisolonäquivalent/Tag > 3 Monate |
1,4 |
* die Risikoindikatoren dienen zusätzlich zu den Risikofaktoren als Indikatoren für eine möglicherweise notwendige Osteoporose-Basisdiagnostik. Sie werden in der Risikokalkulation nicht berücksichtigt.
Die Empfehlungen beziehen sich auf Risiken, die aktuell bestehen oder vor weniger als 12-24 Monaten beendet wurden. Für viele dieser Risiken wird in den verfügbaren Studien eine zumindest partielle Reversibilität des Frakturrisikos nahegelegt (siehe dazu die einzelnen Unterkapitel im Kapitel Risikofaktoren).
Bei klinischen oder anamnestischen Hinweisen auf ein erhöhtes Sturzrisiko, insbesondere bei Einnahme von sturz-begünstigenden Medikamenten, sollte anhand von Sturz- oder Orthostasetests sowie Fragen nach Sedierung oder Schwindel eruiert werden, ob – ggf. nach Therapieumstellung oder anderen Interventionen wie Visusverbesserung oder Verbesserung des Wohnumfeldes – ein erhöhtes Sturzrisiko fortbesteht.
Für alle in Gruppen sortierten Risikofaktoren soll bei gleichzeitigem Vorliegen mehrerer Risikofaktoren nur der stärkste Risikofaktor berücksichtigt werden. Dies geschieht, um eine Überschätzung des Frakturrisikos bei nicht vollständig bekannten Interaktionen zwischen verschiedenen Risikofaktoren einer Gruppe zu umgehen. Aus der Gruppe der Sturzrisiko-assoziierten Risikofaktoren ist das messbare Ergebnis des Timed up and Go Tests ab dem Alter von 70 Jahren zu berücksichtigen.
Ein weiterer zusätzlicher Risikofaktor kann aus einer anderen Gruppe von Risikofaktoren mit in Betracht gezogen werden, aber nicht mehr als zwei der in den Listen genannten Risikofaktoren. Dies betrifft alle Risikofaktorkonstellationen.
Inzidente Frakturen gehen mit einer deutlichen, bei vertebralen Frakturen und Schenkelhalsfrakturen belegt imminenten Frakturrisikoerhöhung einher, für Humerusfrakturen und Beckenfrakturen weisen erste Daten daraufhin (s. Kapitel Risikofaktoren). Des Weiteren zählen mehrere Sturzereignisse innerhalb eines Jahres zu den Risikofaktoren, die das Hüftfrakturrisiko imminent erhöhen, sowie eine innerhalb der letzten 12 Monate eingeleitete Glucocorticoid-Therapie in Dosierungen > 5 mg/Tag > 3 Monate.
Definition imminentes Frakturrisiko:
Sehr hohes Risiko für eine unmittelbar bevorstehende Fraktur, bedingt durch einen plötzlich aufgetretenen, sehr starken Frakturrisikofaktor, der eine kurzfristige, deutliche Frakturrisikoerhöhung bewirkt.
Je höher das Frakturrisiko ist, desto dringlicher und vorrangiger ist die Indikationsstellung für eine weitergehende Diagnostik bzw. Therapieeinleitung. Zahlreiche Beobachtungsstudien zeigen konsistent, dass bei einer Osteoporose-typischen Fraktur bei Personen ab 50 Jahren das Risiko, weitere Frakturen zu erleiden, stark erhöht ist, in etwa zusätzlich verdoppelt, und es in den folgenden 12 Monaten am größten ist (s. Kapitel Risikofaktoren-Fraktur). Aus diesem Grund ist eine rasche Basisdiagnostik allgemein anerkannter Standard.
Die Versorgungssituation der frakturierten postmenopausalen Patientinnen und Patienten ab 50 Jahren könnte evtl. verbessert werden, wenn bei chirurgisch versorgten Frakturen der Hinweis auf eine notwendige Überprüfung des Frakturgeschehens mit der Frage nach osteoporotischer Genese bereits im Entlassungsbrief der chirurgischen Erstversorger festgehalten würde.
Aus den Ausführungen ergibt sich folgende Empfehlung:
| Empfehlung | |
|
Bei allen Frakturen ab einem Alter von 50 Jahren soll eine Abschätzung des Frakturrisikos zeitnah erfolgen. Das gilt gleichermaßen für postmenopausale Frauen unter 50. Bei Hinweisen auf eine Fragilitätsfraktur soll eine Basisdiagnostik zeitnah erfolgen. |
Empfehlungsgrad A |
| Evidenzgrad 2++ |
|
| Konsensstärke 16/16 Starker Konsens |
|
| Leitlinienadaptation:
SIGN Kapitel 3.2.4: Gehlbach, S., Saag, K. G., Adachi, J. D., Hooven, F. H., Flahive, J., Boonen, S., … & Lindsay, R. (2012). Previous fractures at multiple sites increase the risk for subsequent fractures: the Global Longitudinal Study of Osteoporosis in Women. Journal of Bone and Mineral Research, 27(3), 645-653.OXFORD 2, keine Angabe zu HRT unverändert zu DVO Leitlinie 2017 |
|
Unverändert bleibt die generelle Empfehlung zur Basisdiagnostik bei Frauen und Männern ab dem 70. Lebensjahr aufgrund des ab diesem Alter erhöhten Frakturrisiko, soweit zukünftige geplante therapeutische Maßnahmen dies rechtfertigen.
| Empfehlung | |
|
Ab dem 70. Lebensjahr sollte eine Osteoporose-Diagnostik angeboten werden.
|
Empfehlungsgrad B |
| Evidenzgrad 2 |
|
| Konsensstärke 16 /16 Starker Konsens |
|
| Leitlinienadaptation:
SIGN (Shepstone L, Lenaghan E, Cooper C, Clarke S, Fong-Soe-Khioe R, Fordham R, et al. Screening in the community to reduce fractures in older women (SCOOP): a randomised controlled trial. Lancet 2018;391(10122):741-7, OXFORD LoE 2(betreffend-hip fracture) |
|
Wie in Kapitel 6 Allgemeine Osteoporose- und Frakturprophylaxe ausgeführt, ist die Sturzneigung ein wichtiger Risikofaktor für Osteoporose-typische Frakturen im höheren Alter. Da die Sturzhäufigkeit ab dem Alter von 70 Jahren deutlich ansteigt, sollte dies zuverlässig erfasst werden (s. Kapitel 6.3. in Generelle Osteoporose- und Frakturprophylaxe).
| Empfehlung | |
|
Ab einem Lebensalter von 70 Jahren sollte regelmäßig eine
Sturzanamnese zur Feststellung des Sturzrisikos erhoben werden, z. B. im Rahmen eines „Geriatrischen Assessments“. |
Empfehlungsgrad A |
| Evidenzgrad 2++ |
|
| Konsensstärke 17 /17 Starker Konsens |
|
| Leitlinienadaptation:
SIGN (NHS Quality Improvement Scotland. Prevention and management of falls. NHS Quality Improvement Scotland; 2010) |
|
| Empfehlung | |
|
Ein auffälliger Timed up and Go – Test (TUG) soll als Frakturrisikofaktor in die Frakturrisikoberechnung ab einem Alter von 70 Jahren einfließen.
|
Empfehlungsgrad A |
| Evidenzgrad 2 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz:
Larsson, B. A. et al. (2021). The timed up and go test predicts fracture risk in older women independently of clinical risk factors and bone mineral density. Osteoporosis international, 32(1), 75-84. OXFORD LoE 2 |
|
Es gibt zudem viele seltene Krankheitsbilder, die mit einem erhöhten Frakturrisiko einhergehen können und bei denen eine Osteoporose-Basisdiagnostik ebenfalls indiziert sein kann. Auch Fragilitätsfrakturen bei jüngeren Erwachsenen bedürfen einer Einzelfallentscheidung. Von diesen seltenen Krankheitsbildern abgesehen, wird unter Abwägung von Nutzen, Schaden und Kosten außerhalb der oben aufgeführten Risikoprofile keine Basisdiagnostik empfohlen. Eine Osteoporose-Basisdiagnostik kann auch bei erniedrigten Messwerten einer quantitativen Ultraschalluntersuchung oder einer QCT-Untersuchung indiziert sein. Einzelheiten hierzu sind in den Kapiteln messtechnische Risikofaktoren zu finden.
In Bezug auf Kinder, Jugendliche, prämenopausale Frauen, Männer bis zum 50. Lebensjahr und Männer und Frauen mit einer sekundären Osteoporose wird auf die Empfehlungen der jeweiligen Fachgesellschaften verwiesen, in deren inhaltlichen Bereich die besonderen Formen der Osteoporose bei diesen Personengruppen fallen.
Das Risikomodell des DVO ist eines unter verschiedenen vorhandenen Modellen zur Bestimmung des Frakturrisikos. Die verschiedenen Risikovorhersagemodelle unterscheiden sich in dem Endpunkt der Frakturvorhersage, sprich dem Frakturendpunkt, den eingeschlossenen Risikofaktoren in das Risikomodell sowie der Zielpopulation, für das das Vorhersagemodell validiert ist.
Die Aussagekraft der verfügbaren Risikovorhersagemodelle in Bezug auf das „therapierbare Risiko“ wird dadurch eingeschränkt, dass die unter Kapitel 4 genannten Einzelrisiken nur teilweise in post hoc-Analysen von Therapiestudien bezüglich Interaktionen der Einzelfaktoren oder, wie z. B. für FRAX, in Bezug auf Interaktionen der Höhe des Gesamtfrakturrisikos, mit der Therapieeffektivität geprüft wurden. Die Abschätzung der Höhe des Gesamtfrakturrisikos ist somit in Bezug auf die therapeutische Effizienz mit Unsicherheiten verbunden.
Im Vergleich wurde der Q-Fracture – Risk – Score in den Metaanalysen von Nayak 2014 und Marques 2015 von allen Scores am besten und qualitativ hochwertig evaluiert (ROC 0,80). Es liegen dazu allerdings ausschließlich Daten aus Großbritannien (UK) vor (Nayak S et al. 2014 📖Nayak S, Edwards DL, Saleh AA, Greenspan SL. Performance of risk assessment instruments for predicting osteoporotic fracture risk: a systematic review. Osteoporos Int. 2014; Jan;25(1):23-49. doi: 10.1007/s00198-013-2504-5. Epub 2013 Oct 9. Evidenzgrad 1a Oxford, Marques A et al. 2015 📖Marques, A. et al. The accuracy of osteoporotic fracture risk prediction tools: a systematic review and meta-analysis. Ann Theum Dis. 74. 1958-67. 2015. Evidenzgrad 2- SIGN).
Folgende Risikofaktoren sind im Q-Fracture-Risk-Score enthalten: Alter, Geschlecht, Rauchen (Nichtraucher, Ex-Raucher, <10, 10-19, >20 Zig/Tag), Alkohol (<1, 1-2, 3-6, 7-9, >9 Units/Tag), Diabetes (Typ 1, 2), Familienanamnese (Vater, Mutter), Heimbewohner (ja, nein), Z. n. Radius-, Wirbelkörper-, Hüft- oder Schulterfraktur. Erhöhte Sturzneigung, Demenz, Krebserkrankung, Asthma oder COPD, Kardiovaskuläre Erkrankungen (KHK, Apoplex, TIA), chron. Lebererkrankung, chronische Niereninsuffizienz (Grad 4 und 5), Morbus Parkinson, Rheumatoide Arthritis oder SLE, Malabsorption (im Besonderen M. Crohn, Colitis ulcerosa, Zöliakie, Steatorrhoe oder blind loop Syndrom), endokrinologische Erkrankungen (Hyperthyreose, Hyperparathyreoidismus, Cushing Syndrom), Epilepsie oder Antiepileptika, Antidepressiva, Glucocorticoide, postmenopausale Hormontherapie, Body-Mass-Index.
Nachteilig ist, dass es keine Validierung außerhalb UK gibt. Bei Glucocorticoiden oral besteht ein dosisabhängiges Risiko, das insbesondere bei Gaben >7,5 mg/d Prednisolonäquivalent sehr hoch und damit gesondert zu berücksichtigen ist (s. o.). Es gibt auch keine Kategorie für eine subklinische Hyperthyreose, Hypogonadismus und Wachstumshormonmangel sowie die axiale Spondyloarthritis, für Frailty oder Sturzneigung, Dauertherapie mit Protonenpumpeninhibitoren, Schleifendiuretika, Monoklonale Gammopathie unklarer Signifikanz (MGUS), HIV-Infektion, Schizophrenie, Opioid-Gebrauch sowie weitere sturzfördernde Medikamente mit Ausnahme der erfassten Antiepileptika und Antidepressiva.
Der Score sieht keine Einbeziehung des DXA-Wertes vor, sodass ein wesentlicher Risikofaktor nicht einbezogen werden kann. Es ist allerding möglich, den Q – Fracture – Risk- Score in der Beratung zur weiter zu empfehlenden Diagnostik einzusetzen.
FRAX ist ein Rechentool, das von einer WHO-Arbeitsgruppe erarbeitet wurde und das auf der Grundlage klinischer Risikofaktoren und optional der DXA-Knochendichte am Schenkelhals sowie des Trabeculare Bone Scores TBS das länderspezifische 10-Jahres-Frakturrisiko für hüftnahe Frakturen und sogenannte “Major osteoporotic Fractures”(MOF) (hüftnahe Frakturen, klinische Wirbelkörperfrakturen, Humerusfrakturen und Unterarmfrakturen) abschätzt. Es kam 2008 auf den Markt (Kanis et al. 2022 📖Kanis JA, McCloskey EV, Johansson H, Oden A, Ström O, Borgström F. Development and use of FRAX in osteoporosis. Osteoporos Int. 2010; Jun;21 Suppl 2:S407-13. Epub 2010 May 13. Evidenzgrad 3b Oxford), zum Zeitpunkt der Einführung von FRAX waren Modelle für acht Nationen erhältlich, heute sind es insgesamt 71 Modelle für 66 Länder in 35 Sprachen (Kanis J et al. 2014 📖Kanis JA, Johansson H, Oden A et al (2014) Worldwide uptakeofFRAX. ArchOsteoporos9:166). Die FRAX-Kalkulationen für Deutschland, Österreich und die Schweiz verwenden jeweils länderspezifische Inzidenzen von hüftnahen Frakturen und Mortalitätsdaten, Daten zum Verhältnis von hüftnahen Frakturen zu anderen Frakturen aus einem schwedischen Frakturregister und länderübergreifende, aus einer Datenbasis von 12 prospektiv weltweit durchgeführten epidemiologischen Studien zu den Interaktionen verschiedener klinischer Risikofaktoren. FRAX berücksichtigt von den in Kapitel 4 aufgeführten klinischen Risikofaktoren nur diejenigen Risikofaktoren, die in den für die Datenbasis von FRAX zugrundeliegenden Kohorten systematisch erfasst wurden, hierbei handelt es sich um die Risikofaktoren frühere Fragilitätsfrakturen, elterliche Hüftfrakturen, Rauchen, systemische Glucocorticoidtherapie, übermäßiger Alkoholkonsum, rheumatoide Arthritis und „andere Ursachen der sekundären Osteoporose“ (Letztere subsumiert in einer Frage). Ein angekündigtes Update mit Erweiterung der Risikofaktoren ist bislang nicht umgesetzt worden (Vandenput L et al. 2022 📖Vandenput, L., Johansson, H., McCloskey, E. V., Liu, E., Åkesson, K. E., Anderson, F. A., … & Kanis, J. A. (2022). Update of the fracture risk prediction tool FRAX: a systematic review of potential cohorts and analysis plan. Osteoporosis international, 33(10), 2103-2136.). Prävalente Wirbelkörperfrakturen finden als Risikofaktoren keine differenzierte Bewertung, sondern werden zusammen mit anderen Frakturen unter Vorfrakturen subsummiert. Die Knochendichtemessung bezieht sich ausschließlich auf Messungen am Femurhals. Damit ergeben sich z. B. im Vergleich zu dem DVO-Risikomodell zum Teil unterschiedliche Graduierungen des Risikoprofils. Um einige, durch die fehlende Erfassung von Risiken in den für die Modellentwicklung untersuchten Kohorten bestehende Einschränkungen zu mindern, sind in den letzten Jahren z. B. für die differenziertere Einbeziehung der Dosis der Glucocorticoide oder für größere Abweichungen der DXA-Messung zwischen der LWS und dem Femur Konstrukte entwickelt worden, um Risikofaktoren, die bisher nur unvollständig abgebildet wurden, durch zusätzliche Modellannahmen besser abzubilden (Kanis J et al. 2011 📖Kanis JA, Johansson H, Oden A, McCloskey EV. Guidance for the adjustment of FRAX according to the dose of glucocorticoids. Osteoporos Int. 2011; Mar;22(3):809-16. doi: 10.1007/s00198-010-1524-7. Epub 2011 Jan 13. Evidenzgrad 2b Oxford , Leslie W et al. 2011 📖Leslie WD, Lix LM; for the Manitoba Bone Density Program. Absolute fracture risk assessment using lumbar spine and femoral neck bone density measurements: Derivation and validation of a hybrid system. J Bone Miner Res. 2011; Mar;26(3):460-7. doi: 10.1002/jbmr.248. Evidenzgrad 2b Oxford, Leslie W et al. 2010 📖Leslie WD1, Lix LM, Johansson H, Oden A, McCloskey E, Kanis JA. Spine-hip discordance and fracture risk assessment: a physician-friendly FRAX enhancement. Osteoporos Int. 2011; Mar;22(3):839-47. doi: 10.1007/s00198-010-1461-5. Epub 2010 Oct 20. Evidenzgrad 1b Oxford).
Eine Besonderheit von FRAX ist die Einbeziehung der länderspezifischen Mortalität. Personen mit einer hohen 10-Jahres-Mortalität können deshalb ein moderates 10-Jahres-Frakturrisiko haben, auch wenn die 2-Jahres- oder 5-Jahres-Frakturrate hoch ist. Im vorgesehenen Update von FRAX ist auch hierfür eine Anpassung vorgesehen (Kanis J et al. 2020 📖Kanis, J. A., Johansson, H., Harvey, N. C., Gudnason, V., Sigurdsson, G., Siggeirsdottir, K., … & McCloskey, E. V. (2020). Adjusting conventional FRAX estimates of fracture probability according to the recency of sentinel fractures. Osteoporosis International, 31, 1817-1828.).
FRAX ist inzwischen in vielen epidemiologischen Studien außerhalb der ursprünglichen Validierungskohorten in Bezug auf die Frakturvorhersage bei Frauen (Leslie W et al. 2010 📖Leslie WD1, Lix LM, Johansson H, Oden A, McCloskey E, Kanis JA. Spine-hip discordance and fracture risk assessment: a physician-friendly FRAX enhancement. Osteoporos Int. 2011; Mar;22(3):839-47. doi: 10.1007/s00198-010-1461-5. Epub 2010 Oct 20. Evidenzgrad 1b Oxford, Ettinger B et al. 2013 📖Ettinger B1, Ensrud KE, Blackwell T, Curtis JR, Lapidus JA, Orwoll ES; Osteoporotic Fracture in Men (MrOS) Study Research Group. Performance of FRAX in a cohort of community-dwelling, ambulatory older men: the Osteoporotic Fractures in Men (MrOS) study. Osteoporos Int. 2013; Apr;24(4):1185-93. doi: 10.1007/s00198-012-2215-3. Epub 2012 Nov 21. Evidenzgrad 1b Oxford, Azagra R et al. 2012 📖Azagra R, Roca G, Encabo G, Aguyé A, Zwart M, Güell S, Puchol N, Gene E, Casado E, Sancho P, Solà S, Torán P, Iglesias M, Gisbert MC, López-Expósito F, Pujol-Salud J, Fernandez-Hermida Y, Puente A, Rosàs M, Bou V, Antón JJ, Lansdberg G, Martín-Sánchez JC, Díez-Pérez A, Prieto- Alhambra D. FRAX(R) tool, the WHO algorithm to predict osteoporotic fractures: the first analysis of its discriminative and predictive ability in the Spanish FRIDEX cohort. BMC Musculoskelet Disord. 2012; Oct 22;13:204. doi: 10.1186/1471-2474-13-204. Evidenzgrad 2b Oxford, Byberg L et al. 2012 📖Byberg L, Gedeborg R, Cars T, Sundström J, Berglund L, Kilander L, Melhus H, Michaëlsson K.Prediction of fracture risk in men: A cohort study. J Bone Miner Res. 2012; Apr;27(4):797-807. doi: 10.1002/jbmr.1498. Evidenzgrad 1b Oxford, Chen P e t al. 2009 📖Chen P, Krege JH, Adachi JD, Prior JC, Tenenhouse A, Brown JP, Papadimitropoulos E, Kreiger N, Olszynski WP, Josse RG, Goltzman D; CaMOS Research Group. Vertebral fracture status and the World Health Organization risk factors for predicting osteoporotic fracture risk. J Bone Miner Res. 2009; Mar;24(3):495-502. doi: 10.1359/jbmr.081103. Evidenzgrad 1b Oxford, Hillier T et al. 2011 📖Hillier TA, Cauley JA, Rizzo JH, Pedula KL, Ensrud KE, Bauer DC, Lui LY, Vesco KK, Black DM, Donaldson MG, Leblanc E, Cummings SR. The WHO absolute fracture risk models (FRAX): Do clinical risk factors improve fracture prediction in older women without osteoporosis? J Bone Miner Res. 2011; Aug;26(8):1774-82. doi: 10.1002/jbmr.372. Evidenzgrad 2b Oxford, Sambrook P et al. 2011 📖Sambrook PN, Flahive J, Hooven FH, Boonen S, Chapurlat R, Lindsay R, Nguyen TV, Díez- Perez A, Pfeilschifter J, Greenspan SL, Hosmer D, Netelenbos JC, Adachi JD, Watts NB, Cooper C, Roux C, Rossini M, Siris ES, Silverman S, Saag KG, Compston JE, Lacroix A, Gehlbach S. Predicting fractures in an international cohort using risk factor algorithms, without bone mineral density. J Bone Miner Res. 2011; Nov;26(11):2770-7. doi: 10.1002/jbmr.503. Evidenzgrad 2b Oxford, Sandhu S et al. 2010 📖Sandhu SK, Nguyen ND, Center JR, Pocock NA, Eisman JA, Nguyen TV. Prognosis of fracture: evaluation of predictive accuracy of the FRAX algorithm and Garvan nomogram. Osteoporos Int. 2010; May;21(5):863-71. doi: 10.1007/s00198-009-1026-7. Epub 2009 Jul 25. Evidenzgrad 2b Oxford, Rubin K et al. 2013 📖Rubin KH, Friis-Holmberg T, Hermann AP, Abrahamsen B, Brixen K. Risk assessment tools to identify women with increased risk of osteoporotic fracture: complexity or simplicity? A systematic review. J Bone Miner Res. 2013; Aug;28(8):1701-17. doi: 10.1002/jbmr.1956. Evidenzgrad 1a Oxford, Donaldson M et al. 2009 📖Donaldson MG, Palermo L, Schousboe JT, Ensrud KE, Hochberg MC, Cummings SR. FRAX and risk of vertebral fractures: the fracture intervention trial. J Bone Miner Res. 2009; Nov;24(11):1793-9. doi: 10.1359/jbmr.090511. Evidenzgrad 2b Oxford, Pluskiewicz W et al. 2010 📖Pluskiewicz W1, Adamczyk P, Franek E, Leszczynski P, Sewerynek E, Wichrowska H, Napiorkowska L, Kostyk T, Stuss M, Stepien-Klos W, Golba KS, Drozdzowska B. Ten-year probability of osteoporotic fracture in 2012 Polish women assessed by FRAX and nomogram by Nguyen et al.-Conformity between methods and their clinical utility. Bone. 2010; Jun;46(6):1661-7. doi: 10.1016/j.bone.2010.02.012. Epub 2010 Feb 13. Evidenzgrad 3b Oxford, Fraser L et al. 2011 📖Fraser LA1, Langsetmo L, Berger C, Ioannidis G, Goltzman D, Adachi JD, Papaioannou A, Josse R, Kovacs CS, Olszynski WP, Towheed T, Hanley DA, Kaiser SM, Prior J, Jamal S, Kreiger N, Brown JP, Johansson H, Oden A, McCloskey E, Kanis JA, Leslie WD; CaMos Research Group. Fracture prediction and calibration of a Canadian FRAX® tool: a population-based report from CaMos. Osteoporos Int. 2011; Mar;22(3):829-37. doi: 10.1007/s00198-010-1465-1. Epub 2010 Dec 16. Evidenzgrad 1b Oxford, Sornay-Rendu E et al. 2010 📖Sornay-Rendu E1, Munoz F, Delmas PD, Chapurlat RD. The FRAX tool in French women: How well does it describe the real incidence of fracture in the OFELY cohort? J Bone Miner Res. 2010; Oct;25(10):2101-7. doi: 10.1002/jbmr.106. Evidenzgrad 1b Oxford, Tamaki J et al. 2011 📖Tamaki J, Iki M, Kadowaki E, Sato Y, Kajita E, Kagamimori S, Kagawa Y, Yoneshima H. Fracture risk prediction using FRAX®: a 10-year follow-up survey of the Japanese Population-Based Osteoporosis (JPOS) Cohort Study. Osteoporos Int. 2011; Dec;22(12):3037-45. doi: 10.1007/s00198- 011-1537-x. Epub 2011 Jan 29. Evidenzgrad 1b Oxford, Bow C et al. 2011 📖Bow CH1, Tsang SW, Loong CH, Soong CS, Yeung SC, Kung AW.. Bone mineral density enhances use of clinical risk factors in predicting ten-year risk of osteoporotic fractures in Chinese men: the Hong Kong Osteoporosis Study. Osteoporos Int. 2011; Nov;22(11):2799-807. doi: 10.1007/s00198-010-1490-0. Epub 2011 Jan 14. Evidenzgrad 2b Oxford, Leslie W et al. 2012, Bolland M et al. 2011 📖Leslie WD, Lix LM, Johansson H, Oden A, McCloskey E, Kanis JA. Does osteoporosis therapy invalidate FRAX for fracture prediction? J Bone Miner Res. 2012; Jun;27(6):1243-51. doi: 10.1002/jbmr.1582. Evidenzgrad 2b Oxford, Adler R et al. 2010 📖Adler RA, Hastings FW, Petkov VI. Treatment thresholds for osteoporosis in men on androgen deprivation therapy: T-score versus FRAX. Osteoporos Int. 2010; Apr;21(4):647- 53. doi: 10.1007/s00198-009-0984-0. Epub 2009 Jun 17. Evidenzgrad 3b Oxford, Cheung E et al. 2012 📖Cheung EY, Bow CH, Cheung CL, Soong C, Yeung S, Loong C, Kung A. Discriminative value of FRAX for fracture prediction in a cohort of Chinese postmenopausal women. Osteoporos Int. 2012; Mar;23(3):871-8. doi: 10.1007/s00198-011-1647-5. Epub 2011 May 12. Evidenzgrad 2b Oxford, Leslie W et al. 2012 📖Leslie WD, Lix LM, Johansson H, Oden A, McCloskey E, Kanis JA. Does osteoporosis therapy invalidate FRAX for fracture prediction? J Bone Miner Res. 2012; Jun;27(6):1243-51. doi: 10.1002/jbmr.1582. Evidenzgrad 2b Oxford, Kanis J et al. 2013 📖Kanis JA, Oden A, Johansson H, McCloskey E. Pitfalls in the external validation of FRAX. Osteoporos Int. 2013; Jan;24(1):391-2. doi: 10.1007/s00198-012-1985-y. Epub 2012 May 15]. Evidenzgrad 2b Oxford) und Männern (Leslie W et al. 2011 📖Leslie WD, Kovacs CS, Olszynski WP, Towheed T, Kaiser SM, Prior JC, Josse RG, Jamal SA, Kreiger N, Goltzman D; CaMos Research Group. Spine-Hip T-Score Difference Predicts Major Osteoporotic Fracture Risk Independent of FRAX (®): A Population-Based Report From CAMOS. J Clin Densitom. 2011; Jul-Sep;14(3):286-93. Epub 2011 Jul 1. Evidenzgrad 1b Oxford, Ettinger B et al. 2013 📖Ettinger B1, Ensrud KE, Blackwell T, Curtis JR, Lapidus JA, Orwoll ES; Osteoporotic Fracture in Men (MrOS) Study Research Group. Performance of FRAX in a cohort of community-dwelling, ambulatory older men: the Osteoporotic Fractures in Men (MrOS) study. Osteoporos Int. 2013; Apr;24(4):1185-93. doi: 10.1007/s00198-012-2215-3. Epub 2012 Nov 21. Evidenzgrad 1b Oxford, Byberg L et al. 2012 📖Byberg L, Gedeborg R, Cars T, Sundström J, Berglund L, Kilander L, Melhus H, Michaëlsson K.Prediction of fracture risk in men: A cohort study. J Bone Miner Res. 2012; Apr;27(4):797-807. doi: 10.1002/jbmr.1498. Evidenzgrad 1b Oxford, Chen P et al. 2009 📖Chen P, Krege JH, Adachi JD, Prior JC, Tenenhouse A, Brown JP, Papadimitropoulos E, Kreiger N, Olszynski WP, Josse RG, Goltzman D; CaMOS Research Group. Vertebral fracture status and the World Health Organization risk factors for predicting osteoporotic fracture risk. J Bone Miner Res. 2009; Mar;24(3):495-502. doi: 10.1359/jbmr.081103. Evidenzgrad 1b Oxford, Sandhu S et al. 2010 📖Sandhu SK, Nguyen ND, Center JR, Pocock NA, Eisman JA, Nguyen TV. Prognosis of fracture: evaluation of predictive accuracy of the FRAX algorithm and Garvan nomogram. Osteoporos Int. 2010; May;21(5):863-71. doi: 10.1007/s00198-009-1026-7. Epub 2009 Jul 25. Evidenzgrad 2b Oxford, Fraser L et al. 2011 📖Fraser LA1, Langsetmo L, Berger C, Ioannidis G, Goltzman D, Adachi JD, Papaioannou A, Josse R, Kovacs CS, Olszynski WP, Towheed T, Hanley DA, Kaiser SM, Prior J, Jamal S, Kreiger N, Brown JP, Johansson H, Oden A, McCloskey E, Kanis JA, Leslie WD; CaMos Research Group. Fracture prediction and calibration of a Canadian FRAX® tool: a population-based report from CaMos. Osteoporos Int. 2011; Mar;22(3):829-37. doi: 10.1007/s00198-010-1465-1. Epub 2010 Dec 16. Evidenzgrad 1b Oxford, Bow C et al. 2011 📖Bow CH1, Tsang SW, Loong CH, Soong CS, Yeung SC, Kung AW.. Bone mineral density enhances use of clinical risk factors in predicting ten-year risk of osteoporotic fractures in Chinese men: the Hong Kong Osteoporosis Study. Osteoporos Int. 2011; Nov;22(11):2799-807. doi: 10.1007/s00198-010-1490-0. Epub 2011 Jan 14. Evidenzgrad 2b Oxford) validiert. Die AUCs liegen bei postmenopausalen Frauen für “Major Fractures” zwischen 0,62 und 0,78 und für Hüftfrakturen zwischen 0,64 und 0,88. FRAX ist auch bezüglich einer Interaktion mit der therapeutischen Effizienz für die meisten Osteoporose-Pharmaka untersucht worden, liefert hier aber für die am häufigsten verschriebenen Medikamente uneinheitliche Ergebnisse, aus denen nicht abgeleitet werden kann, dass FRAX gegenüber DXA-basierten Verfahren eine bessere Abschätzung der therapeutischen Effizienz liefert (Donaldson M et al. 2009 📖Donaldson MG, Palermo L, Schousboe JT, Ensrud KE, Hochberg MC, Cummings SR. FRAX and risk of vertebral fractures: the fracture intervention trial. J Bone Miner Res. 2009; Nov;24(11):1793-9. doi: 10.1359/jbmr.090511. Evidenzgrad 2b Oxford, Kanis J et al. 2011 📖Kanis JA, Johansson H, Oden A, McCloskey EV. Guidance for the adjustment of FRAX according to the dose of glucocorticoids. Osteoporos Int. 2011; Mar;22(3):809-16. doi: 10.1007/s00198-010-1524-7. Epub 2011 Jan 13. Evidenzgrad 2b Oxford, McCloskey E et al. 2012 📖McCloskey EV, Johansson H, Oden A, Austin M, Siris E, Wang A, Lewiecki EM, Lorenc R, Libanati C, Kanis JA. Denosumab reduces the risk of osteoporotic fractures in postmenopausal women, particularly in those with moderate to high fracture risk as assessed with FRAX®. J Bone Miner Res. 2012; Jul;27(7):1480-6. doi: 10.1002/jbmr.1606. Evidenzgrad 1+ SIGN, Kanis J et al. 2010 📖Kanis JA, McCloskey EV, Johansson H, Oden A, Ström O, Borgström F. Development and use of FRAX in osteoporosis. Osteoporos Int. 2010; Jun;21 Suppl 2:S407-13. Epub 2010 May 13. Evidenzgrad 3b Oxford, Kanis J et al. 2009 📖Kanis JA, Johansson H, Oden A, McCloskey EV. Bazedoxifene reduces vertebral and clinical fractures in postmenopausal women at high risk assessed with FRAX((R)). Bone. 2009; Jun;44(6):1049-54. doi: 10.1016/j.bone.2009.02.014. Epub 2009 Feb 28. Evidenzgrad 1+ SIGNd). Daten einer Metaanalyse von 2017 zeigten, dass bei Verwendung der 10-Jahres-Interventionsschwellenwerte von 20 % für MOF und 3 % für HF die Identifizierung von Patientinnen und Patienten, die innerhalb von 10 Jahren keine MOF oder Hüftfraktur erlitten, besser war als die Identifizierung der später frakturierten Patientinnen und Patienten (Jiang X et al. 2017 📖Jiang, X., Gruner, M., Trémollieres, F., Pluskiewicz, W., Sornay-Rendu, E., Adamczyk, P., & Schnatz, P. F. (2017). Diagnostic accuracy of FRAX in predicting the 10-year risk of osteoporotic fractures using the USA treatment thresholds: a systematic review and meta-analysis. Bone, 99, 20-25. OXFORD LoE 2).
Der DVO hat ein Modell zur Vorhersage von Frakturen entwickelt, das Alter, Geschlecht, DXA-Messung und klinische Risikofaktoren einbezieht und als primären Zielparameter die Vorhersage von Wirbelkörperfrakturen (klinisch und radiologisch) und Hüftfrakturen hat. Zur Abschätzung des absoluten Risikos wurde auf Frakturdaten aus der Schweiz und der Niederlande (“Rotterdam-Studie”), auf die Daten der “European Prospective Osteoporosis Study (EPOS)”, an der auch deutsche Zentren beteiligt waren, sowie in einigen Aspekten auf Daten aus den USA zurückgegriffen. Eine Validierung in Bezug auf die Verwendbarkeit für Entscheidungen zur medikamentösen Therapie wurde 2012 anhand der Daten der “FREEDOM- Studie” durchgeführt (Hadji P et al. 2013 📖Hadji P, Bock O, Resch H, Kraenzlin M, Wang A, Steinle T, Eisen C. Reduction of fracture risk with denosumab among women with osteoporosis with or without need for treatment according to DVO guideline. A subgroup analysis of the FREEDOM trial. Osteologie 2013; 22: 39-45.).
Die bislang gültige Leitlinie Osteoporose des DVO basiert, wie bereits ausgeführt, seit 2006 auf einem Risikomodell, dem die Schenkelhalsfrakturen und die Wirbelkörperfrakturen als Zielgröße zugrunde liegen. Die zugrundliegenden Daten stammten aus den D-A-CH Mitgliedsländern des DVO und waren insgesamt begrenzt, insbesondere für Männer. Grund genug, das Modell zu überarbeiten und gleichzeitig an der Entwicklung eines Risikorechners zu arbeiten. Dieser soll die Diagnostik, die auf multiplen Risikofaktoren basiert, erleichtern. Mit der Möglichkeit, rechnerunterstützte Risikomodellierungen durchzuführen, wurde der Frakturprädiktions-Algorithmus weiterentwickelt.
Referenzdaten neues Risikomodell
Die Risikoabschätzung basiert auf deutschen Referenzdaten. Anhand von Krankenkassendaten (CLAIMS Daten von 607.153 Patientinnen und Patienten, hiervon 353.175 Frauen und 253.978 Männer, im Alter von 50-100 Jahren) wurde die Inzidenz von codierten dokumentierten Wirbelfrakturen und Schenkelhalsfrakturen analysiert.
| Codierungen für vertebrale Frakturen |
Thoracal: S22.02, S22.03, S22.04, S22.05, S22.06 Lumbal: S32.01,S32.02,S32.03,S32.04,S32.05 |
| Codierungen für Schenkelhalsfrakturen | 72.0, 72.1, 72.1, S72.2, S72.0x außer S72.08, M 80.x5* |
Neben der Inzidenz der Wirbelfrakturen (hierunter sind dokumentierte, codierte Wirbelfrakturen zusammengefasst) und Schenkelhalsfrakturen wurden Wirbelkörper- und Schenkelhalsfrakturen als Prädiktoren für weitere Frakturen ausgewertet, für diese Analyse wurden Codierungen für vertebrale Frakturen ergänzt (M8008, M8058, M8088, M8098, S220, S2200, S320, S3200).
Somit ändert sich die Grundlage zur Berechnung des vertebralen Frakturrisikos, die sich nun auf codierte vertebrale Frakturen bezieht, bei denen die Unterscheidung klinisch/radiologisch nicht direkt am Code erkennbar ist. Des Weiteren ist anzunehmen, dass da, wo rein radiologisch manifestierte Wirbelkörperfrakturen nicht systematisch erfasst wurden, die Anzahl der vertebralen Frakturen insgesamt eher unterschätzt wird.
Multiplikatives Modell basierend auf Cox Proportional Hazards
Die Modellierung des Frakturrisikos erfolgt über ein multiplikatives Modell: An das Grundfrakturrisiko von Personen ohne klinische Risikofaktoren wird das relative Risiko der bei Patientinnen- und Patienten-individuell vorliegenden klinischen Risikofaktoren (relative Risiken der zwei stärksten klinischen Risikofaktoren) berücksichtigt bzw. Knochendichtemessungsergebnisse multipliziert. Hierbei werden Interaktionen mit Alter und zwischen Paaren von klinischen Risikofaktoren mit modelliert, soweit aus den Krankenkassendaten ableitbar. Die Interaktion von Risikofaktoren wurde innerhalb des Krankenkassendatensatzes analysiert. Bei den allermeisten solcher Risikofaktorpaaren multipliziert sich das relative Risiko (RR) der beiden Einzelfaktoren zum Kombinations-RR. Dabei gibt es eine Untermenge von etwa 10-15 % Kombinationen, bei denen die Gesamtwirkung der beiden Risikofaktoren deutlich geringer ausfällt, als es einer direkten Multiplikation der beiden relativen Einzelrisiken entspräche. Dies wird bei entsprechender Kombination im Risikorechner berücksichtigt und mit abgebildet. Um eine Überschätzung des Frakturrisikos in der Übergangszeit zu vermeiden, bleibt die Zahl der zu multiplizierenden Risikofaktoren auf zwei reduziert, die zudem aus zwei verschiedenen Gruppen von Risikofaktoren stammen müssen (s. auch Kapitel Indikation für eine medikamentöse Therapie).
Die Risikofaktoren, die im Kapitel Risikofaktoren und Basisdiagnostik eingeschlossen sind, und die in die CLAIMS Datenanalyse hinsichtlich Frakturprädiktion eingeschlossen wurden, unterlagen (wie insgesamt alle untersuchten Risikofaktoren) einer umfassenden systematischen Literatur-Recherche nach standardisierten Evidenzkriterien (2011 Oxford Center of Evidence Based Medicine Levels of Evidence, primär Metaanalysen, s. auch Leitlinienreport und Report zum Risikorechner), ergänzt durch in Experten-Handsearch gefundene Literatur, der erneut eine systematische Recherche zugrunde lag. Insgesamt wurden über 2267 Literaturstellen durchgearbeitet, aus denen sich 101 Kandidaten für relevante Risikofaktoren ergaben. Aus diesen wurden die prädiktivsten und ausreichend prävalenten, also die für die Praxis relevantesten klinischen Risikofaktoren ausgewählt. Die Anzahl an klinischen Risikofaktoren, die so priorisiert in das Risikomodell primär eingeschlossen wurden, beträgt 32 + Alter, insgesamt 33 (s. Kapitel 8.3. und Kapitel 4).
Konstant bleibt der Endpunkt Hüft- und Wirbelkörperfraktur in der Frakturvorhersage, da diese das höchste Mortalitätsrisiko, die höchsten Einbußen an Lebensqualität und die höchsten Kosten pro Fraktur verursachen.
Konstant bleibt, dass zwischen Graden prävalenter Wirbelkörperfrakturen und nicht-vertebraler Frakturen unterschieden wird, was eine individuellere Risikokategorisierung (als beispielsweise beim FRAX) ermöglicht.
Konstant bleibt der Bezug auf die Knochendichteergebnisse mehrerer Messorte, insgesamt basiert das Frakturrisiko auf der DXA-Messung am Gesamtfemur aufgrund des verbundenen Risikogradienten, der stärker als bei den Messorten Femurhals und Lendenwirbelsäule ist, mit einer Option zu Adjustierungen, falls die DXA-Messung an der Wirbelsäule im T-Score stark vom T-Score Total Hip abweicht. Gleichzeitig leitet dieser Punkt zu den Änderungen über.
Verrechnung der drei Messorte über Anpassung des Gesamthüft T-Scores.
Bisher wurde in den DVO-Leitlinien der Wert des niedrigsten T-Scores für die Therapieindikation zugrunde gelegt. Dieser liefert aber nicht die stärkste Frakturrisikovorhersage. Zum einen entspricht der niedrigste T-Score nicht immer dem größten Risiko, zum zweiten liefert weder der niedrigste T-Score noch der höchste unter den an den drei Messorten beobachteten Frakturrisikowerten die korrekteste Frakturrisikovorhersage. Vielmehr lässt sich die beste Risikoabschätzung aus einer Kombination der zwei oder drei Risikowerte ermitteln. Hierfür kann ein Ansatz verwendet werden, der von Bill Leslie entwickelt wurde (Leslie W et al 2011 📖Leslie WD, Lix LM; for the Manitoba Bone Density Program. Absolute fracture risk assessment using lumbar spine and femoral neck bone density measurements: Derivation and validation of a hybrid system. J Bone Miner Res. 2011; Mar;26(3):460-7. doi: 10.1002/jbmr.248. Evidenzgrad 2b Oxford), bei dem vom areal BMD Messergebnis an der Gesamthüfte ausgegangen wird und dessen T-Score angepasst wird, je nachdem, wie weit die T-Scores an den anderen Messorten abweichen. Für diesen angepassten Gesamtfemur T-Score, kann dann das RR der Knochendichte für SHF oder WKF errechnet werden. Eine Verrechnung soll zusätzlich für den Trabecular Bone Score (TBS) Wert erfolgen. Für den Risikorechner werden deutsche Referenzdaten für die Knochendichtedaten verwendet werden (Paggiosi M et al. 2011 📖Paggiosi MA, Glueer CC, Roux C, et al. International variation in proximal femur bone mineral density. Osteoporos Int 2011; 22: 721–729. doi:10.1007/s00198-010-1336-9, Lehmann R et al. 1995 📖Lehmann R, Wapniarz M, Randerath O, et al. Dual-energy X-ray absorptiometry at the lumbar spine in German men and women: A cross-sectional study. Calcif Tissue Int 1995; 56: 350–354. doi:10.1007/BF00301600).
Der Vorhersagezeitraum wird von 10 Jahren auf 3 Jahre reduziert. Aus ärztlicher und Sicht der Patientinnen und Patienten ist dies ein Zeitraum, der durch die randomisierten prospektiven Therapiestudien von nahezu allen zugelassenen medikamentösen Therapien abgebildet wird, der zeitlich wesentlich besser eingeschätzt und für die Patientinnen und Patienten abgebildet werden kann, was zum besseren Verständnis der Therapieentscheidung beitragen kann. Hierbei ist zu beachten, dass die prozentuale Veränderung der Frakturrisikowerte unter Therapie sich von Frakturort zu Frakturort und Anzahl der Frakturen unterscheidet, was im Kapitel 9.5 medikamentöse Therapie abgebildet ist.
Bei einem Vorhersagezeitraum von 3 Jahren spielt auch das Thema der Mortalität als „konkurrierendes Risiko“ zum Frakturereignis keine problematische Rolle. Bei 10 Jahren hingegen ist es für ältere Patientinnen und Patienten bei Einbeziehung der Mortalität zusätzlich erschwert, die Therapieindikationsbedingungen zu erfüllen, was z. B. bei FRAX der Fall ist.
Einige Risikofaktoren führen zeitlich begrenzt zu einer übersteigerten drohenden Gefahr für das Auftreten einer erneuten Fraktur, was in mehreren Publikationen der letzten Jahre gezeigt wurde und im Kapitel Risikofaktoren an entsprechender Stelle hervorgehoben wird sowie im Risikorechner abgebildet wird. Diese plötzlich neu auftretende Risikofaktorkonstellation wird als imminentes Frakturrisiko bezeichnet (imminent (engl.) = unmittelbar bedrohlich bevorstehend). Die Berücksichtigung des imminent erhöht liegenden Frakturrisikos soll dazu führen, dass durch gezielte Maßnahmen das Folgefrakturrisiko effizient gesenkt wird (s. Kapitel medikamentöse Therapie). Faktoren des imminenten Frakturrisikos sind: Hüftfraktur und vertebrale Fraktur in den direkt zurückliegenden 12 Monaten, eine neu begonnene und fortgeführte Glucocorticoidtherapie >= 7,5 mg/d in den vergangenen 12 Monaten und zwei oder mehr Sturzereignisse in den vergangenen 12 Monaten. Die Risikofaktoren werden explizit in der Tabelle genannt und können so auch in Tabellenform berücksichtigt werden.
Das Ergebnis der Knochendichte und – soweit vorhanden – bis zu zwei klinischen Risikofaktoren (inkl. möglicher Erhöhung durch Faktoren des imminenten Frakturrisikos) werden neben Alter und Geschlecht in die Berechnung des Frakturrisikos einbezogen. Dabei werden vom Risikorechner automatisch die zwei stärksten Risikofaktoren, also diejenigen mit dem höchsten relativen Risiko, berücksichtigt, falls mehr als zwei Risikofaktoren eingegeben werden. Alle weiteren vorliegenden klinischen Risikofaktoren sollen durch den Risikorechner aufgelistet werden, sodass sich ein Gesamtbild des vorliegenden Risikofaktorenprofils ergibt, das bei der therapeutischen Entscheidung i. S. von begründeten Einzelfallentscheidungen berücksichtigt werden kann.
Der Risikorechner selber liefert nur Informationen zum Frakturrisiko. Das Ergebnis wird nicht mit einer Diagnose oder einer Therapieempfehlung verbunden sein. Diese leitet sich, basierend auf dem ermittelten Frakturrisiko-Niveau, aus den Empfehlungen der Leitlinien ab. Es soll auf der Oberfläche des Risikorechners hierzu Links zu Informationen der Leitlinie geben, sodass Kontext-bezogene Informationen leicht einzusehen sind. Bevor der Risikorechner verfügbar ist, müssen die zwei stärksten Risikofaktoren anhand der Tabellen bestimmt werden.
Risikokalkulationen sind nur bei einem Alter zwischen 50 und 90 Jahren möglich.
Neue, an den geänderten 3-Jahres Zeitraum und aktuelle deutsche Referenzdaten angepasste Therapieindikationsschwellen sind definiert worden. Sie beziehen sich auf das dreijährige Risiko für Schenkelhalsfrakturen und Wirbelkörperfrakturen (s. Kapitel medikamentöse Therapie hinsichtlich Therapieoptionen und Therapieindikation für Einzelheiten).
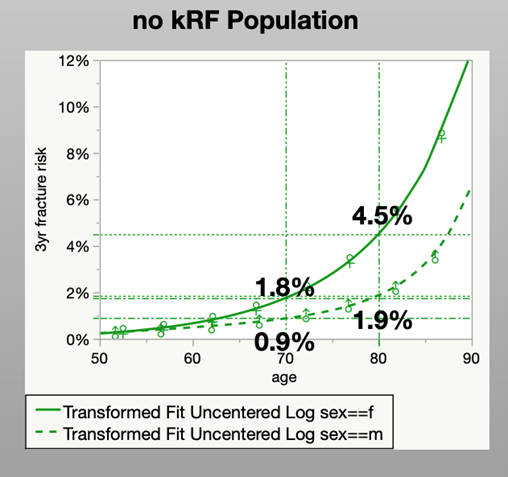
In der Allgemeinbevölkerung beträgt im Alter von 70 Jahren die Inzidenz für vertebrale und Schenkelhalsfrakturen, die anhand des Krankenkassendatensatzes analysiert wurde, für Frauen 3 %, für Männer 1,6 %, im Alter von 80 Jahren für Frauen 7,1 % und für Männer 3,7 %. Nach Ausschluss aller Risikofaktoren der Leitlinie (supergesunde Population), liegt die Inzidenz für vertebrale und Schenkelhalsfrakturen für Frauen bei 1,7 %, bei Männern bei 0,9 % im Alter von 70 Jahren, respektive 4,4 % und 1,8 % im Alter von 80 Jahren.
Diese Inzidenzzahlen sind Basis der Berechnungen zu Therapieschwellen, an sie wird das relative Risiko der beiden stärksten Risikofaktoren heranmultipliziert. Mithilfe des neuen DVO- Algorithmus, der 33 analysierten Risikofaktoren sowie im Vergleich zum FRAX-Risikomodell und dessen Interventionsschwellen wurden die Therapieschwellen abgeleitet.
Zwischen 3- und 5%igem Frakturrisiko/3 Jahre für vertebrale und Schenkelhalsfrakturen wird ein „Behandlungskorridor“ für Patientinnen und Patienten mit irreversiblen und/oder starken Risikofaktoren oder sehr hohem Frakturrisiko für eine bevorstehende Fraktur („imminentes Frakturrisiko“) eröffnet, der eine Therapie bereits bei niedrigeren Schwellenwerten zur frühzeitigen Therapieeinleitung ermöglicht.
Bei 5 % /3-Jahresfrakturrisiko soll eine Therapie empfohlen werden, eine Schwelle, die sich an der Therapieschwelle der Leitlinie 2017 ausrichtet. Im Durchschnitt wird sie im Alter von 76 Jahren bei Frauen erreicht (Vergleich „Treppen“ Therapieindikationsschema DVO 2017).
Doppelt so hoch liegt die Indikation zur osteoanabolen Therapieempfehlung, osteoanabol FIRST einschließend, eine Schwelle, die sich an internationalen Empfehlungen zur Einleitung einer osteoanabolen Therapie sowie Ergebnissen klinischer Studien orientiert (Curtis E et al. 2022 📖Curtis, E. M., Reginster, J. Y., Al-Daghri, N., Biver, E., Brandi, M. L., Cavalier, E., … & Cooper, C. (2022). Management of patients at very high risk of osteoporotic fractures through sequential treatments. Aging clinical and experimental research, 34(4), 695-714.).
Die folgende Tabelle stellt die konsentierten Empfehlungen (Kapitel medikamentöse Therapie) in einer Übersicht dar:
| 3-Jahres Frakturrisiko | Empfehlung zur Therapie |
| ab 3 % | Eine spezifische medikamentöse Therapie sollte ab einem 3- Jahres Frakturrisiko zwischen 3 % und 5 % für Schenkelhalsfrakturen und Wirbelkörperfrakturen in Betracht gezogen werden, wenn starke oder irreversible Risikofaktoren oder ein sehr hohes Risiko einer unmittelbar bevorstehenden Fraktur („imminent fracture risk“) vorliegen. |
| ab 5 % | soll eine Therapie empfohlen werden |
| ab 10 % | Soll eine osteoanabole Therapie empfohlen werden, ggf. auch als Ersttherapie (Kapitel Therapie Hinweis). |
Sondervotum der DEGAM zu 10 % Therapieschwelle: Eine osteoanabole Therapie sollte empfohlen werden (s. Kapitel medikamentöse Therapie)
Nach der Zertifizierung des Risikorechners erfolgt für die Präzisierung dieser Einschätzung eine Akutaktualisierung.
Der Risikorechner kann nach Zertifizierung entweder auf einem Desktop-Rechner durch Aufruf über einen der Standard-Browser oder als Web-App auf dem Mobiltelefon genutzt werden. Er soll Osteologinnen und Osteologen kostenfrei zur Verfügung stehen.
Aufgrund des Zeitverzugs zwischen Abschluss der Programmierung des Risikorechners und seiner Zertifizierung wird für die Übergangszeit eine neue Tabelle angeboten, anhand derer man das Frakturrisiko und die Therapiebedürftigkeit näherungsweise abschätzen kann. Näherungsweise deshalb, weil es für eine exakte Abschätzung des Frakturrisikos mehrerer unterschiedlicher Tabellen bedürfte (Männer versus Frauen, jeweils eine für jeden Knochendichtemessort usw.), was nicht praktikabel ist.
Die Papierversion des Risikorechners verwendet die Ergebnisse der DXA Knochendichtemessung an der Gesamthüfte als BMD Messort. Zwei separate Tabellen, eine für Männer und eine für Frauen, führen in Abhängigkeit von Alter und aBMD Wert an der Gesamthüfte den Faktorwert auf, der durch vorliegende klinische Risikofaktoren mindestens erreicht werden muss, um die jeweilige Therapieindikationsschwelle von 3 %, 5 % oder 10 % zu erreichen (s. Tabelle Kapitel 9). Für diese Bestimmung ist die Tabelle der Risikofaktoren (33 mit Risikofaktor Alter) vorgesehen, aus der das RR für die jeweiligen Risikofaktoren ablesbar ist (s. Tabelle). Das RR bildet einen (gewichteten) Mittelwert aus den RRs für SHF und WKF ab.
Diese Übergangsversion ist suboptimal und dennoch der bisherigen Tabelle zur Therapieindikationsbestimmung auch aufgrund der besseren Abbildung des Frakturrisikos für Männer vorzuziehen. Die alte DVO-Tabelle sollte nur in Ausnahmefällen, wenn z. B. eine Versorgungskontinuität nicht anderes gesichert werden kann, weiter genutzt werden. Die Papiertabellen sollen generell entfallen, sobald der Risikorechner eingesetzt werden darf.
Das Modell wird in Bezug auf die Vorhersagekraft von Frakturen und Abschätzbarkeit seiner therapeutischen Effizienz aktuell mit vorhandenen Modellen verglichen und validiert.
Aus den genannten Punkten unter 7.6.-7.7. ergeben sich folgende begründende Punkte für die dann folgenden Empfehlungen:
Das neue DVO-Modell ist dem alten sowie anderen verfügbaren Risikorechnern aufgrund
somit der intensiven zugrundliegenden Datenanalyse vorzuziehen.
Die parallel zum Zertifizierungsprozess vorgesehene Validierung soll dies überprüfen. Die praktikableren Schwellenwerte, die sich auf einen 3-Jahreszeitraum beziehen, der im shared decision making mit den Patientinnen und Patienten einfacher vermittelbar ist und durch Einbezug des 1-Jahres-Frakturrisikos als imminentes Frakturrisiko therapeutisch wichtige Konsequenzen im Sinne einer besseren Patientenversorgung umfasst, sind klinisch aufgrund der mangelhaften Versorgungssituation der Osteoporose-Patientinnen und -Patienten in Deutschland (McCloskey E et al. 2021 📖McCloskey EV, Johansson H, Oden A, Austin M, Siris E, Wang A, Lewiecki EM, Lorenc R, Libanati C, Kanis JA. Denosumab reduces the risk of osteoporotic fractures in postmenopausal women, particularly in those with moderate to high fracture risk as assessed with FRAX®. J Bone Miner Res. 2012; Jul;27(7):1480-6. doi: 10.1002/jbmr.1606. Evidenzgrad 1+ SIGN) i. S. einer besseren Versorgung zu favorisieren.
Es gibt zudem keine direkte Evidenz für definierte Diagnoseschwellen und deren differentielle Auswirkung auf weitere Frakturen und das Befinden der Patientinnen und Patienten, sodass die begründeten Therapieschwellen verwendet werden können.
| Empfehlung | |
|
Für die Abschätzung des Frakturrisikos sollte das neue DVO-Risikomodell verwendet werden.
|
Empfehlungsgrad A |
| Evidenzgrad Expertenkonsens |
|
| Konsensstärke 19/19 Starker Konsens |
|
| Empfehlung | |
|
Das Frakturrisiko soll für 3 Jahre bestimmt werden.
|
Empfehlungsgrad A |
| Evidenzgrad Expertenkonsens |
|
| Konsensstärke 17 / 17 Starker Konsens |
|