Aufgrund der fortlaufenden Änderungen der Fachinformationen der Basistherapie und der spezifischen medikamentösen Therapie der Osteoporose wird in Bezug auf die Indikationen, Kontraindikationen, Nebenwirkungen, Hinweise und Vorsichtsmaßnahmen auf die jeweils gültige und aktuelle Fachinformation verwiesen. Die nachfolgenden Einschätzungen geben den aktuellen Stand der Fachinformationen wieder.
Gegenstand dieses Kapitels sind Empfehlungen zur Therapie der Osteoporose bei Männern ab 50 Jahren und bei postmenopausalen Frauen.
Für Kinder, Jugendliche, prämenopausale Frauen, Frauen und Männer mit einer schweren Niereninsuffizienz und Frauen und Männer mit einer sekundären Osteoporose wird auf die Empfehlungen der jeweiligen Fachgesellschaften verwiesen, in deren inhaltlichen Bereich die besonderen Formen der Osteoporose bei diesen Personengruppen fallen.
Die Osteoporose-Therapie wird in Basistherapie und spezifische Therapie unterschieden. Grund hierfür ist, dass in Abhängigkeit von der Ausprägung des Frakturrisikos und bereits einer eingetretenen Osteoporose-typischen Fraktur unterschiedliche Strategien und Therapien zur Prävention von Frakturen empfehlenswert sind.
Die Primärprävention richtet sich an die Gesamtbevölkerung unabhängig vom individuellen Risiko, um sowohl auf individueller, insbesondere aber auf Bevölkerungsebene das Risiko osteoporotischer Frakturen zu minimieren. Die Sekundärprävention dient der Erkennung und Behandlung von Menschen mit einem individuell deutlich erhöhten Risiko solcher Frakturen. Als Tertiärprävention wird die Verhinderung weiterer Frakturen bei Menschen mit bereits mindestens einer Osteoporose-typischen Fraktur bezeichnet. Die Basistherapie oder Basisempfehlungen gelten für alle Präventionsformen, die spezifische Therapie (Kapitel 9.5.) in der Sekundär- und Tertiärprävention.
Bei allen Risikopersonen wird, unabhängig von einer spezifischen medikamentösen Therapie, eine Umsetzung der generellen Maßnahmen zur Prophylaxe von Frakturen empfohlen. Die Barrieren, die eine Umsetzung der allgemeinen Prophylaxe-Maßnahmen erschweren, sollten eruiert und, wenn möglich, beseitigt werden.
Bei Patientinnen und Patienten mit einer Glucocorticoid-Therapie sollte zur Minimierung des bereits durch die Grundkrankheit bedingten erhöhten Frakturrisikos eine suffiziente, eventuell intensivierte Behandlung der Grunderkrankung mit optimaler Reduktion der Krankheitsaktivität angestrebt werden. Dabei ist empfohlen, Glucocorticoide unter individueller Abwägung von Risiko und Nutzen so kurz und niedrig wie nötig zu dosieren.
| Empfehlung | |
|
Die Umsetzung der generellen Maßnahmen zur Prophylaxe von Frakturen soll bei allen Risikogruppen erfolgen.
|
Empfehlungsgrad A |
| Evidenzgrad Expertenkonsens |
|
| Konsensstärke 18/18 Starker Konsens |
|
| Empfehlung | |
|
Beeinflussbare Risikofaktoren sollen nach Möglichkeit minimiert werden.
|
Empfehlungsgrad A |
| Evidenzgrad Expertenkonsens |
|
| Konsensstärke 18/18 Starker Konsens |
|
Durch eine psychosoziale Betreuung von Patientinnen und Patienten nach Stürzen und Frakturen sollte der Angst vor weiteren Ereignissen und dem Circulus vitiosus einer weiteren Mobilitätseinschränkung entgegengewirkt werden. Zur Verbesserung und /oder zum Erhalt der Teilhabe kann auch ein Training der Handlungsfähigkeiten in den individuellen Lebensbereichen beitragen. Der Kontakt mit fachlich ausgewiesenen Selbsthilfegruppen ist zu empfehlen (Verweis auf Kapitel 9.6. mit Details zur Schmerztherapie).
| Empfehlung | |
|
Weitere begleitende Maßnahmen zur Krankheitsbewältigung sollten empfohlen werden (z. B. Selbsthilfegruppen)
|
Empfehlungsgrad B |
| Evidenzgrad Expertenkonsens |
|
| Konsensstärke 18/18 Starker Konsens |
|
Es wird auch auf Kapitel 6.2 verwiesen.
Bezüglich der Empfehlungen zu der Therapie mit Calcium und Vitamin D ist zu unterscheiden
Für Osteoporose-Patientinnen und Osteoporose-Patienten ohne eine spezifische medikamentöse Osteoporose-Therapie wird eine Zufuhr von 1.000 mg Calcium täglich mit der Nahrung als Basistherapie empfohlen. Nur, wenn die empfohlene Calciumzufuhr mit der Nahrung nicht erreicht wird, sollte eine Supplementierung mit Calcium durchgeführt werden. Hierbei sind hochdosierte Einzelgaben nicht empfohlen. Eine Überprüfung der Calciumzufuhr kann beispielsweise durch spezielle Fragebögen zur Ernährung erfolgen. Eine Supplementierung mit 800 bis 1.000 internationalen Einheiten Vitamin D3 täglich wird bei unzureichender oder unsicherer Eigenproduktion oder Zufuhr mit der Nahrung empfohlen.
In vielen Therapiestudien wurde eine Supplementierung mit Calcium und Vitamin D durchgeführt. Aufgrund der Möglichkeit von Hypokalzämien unter einer antiresorptiven Therapie der Osteoporose ist eine ausreichende Versorgung mit Calcium und Vitamin D bei allen Patientinnen und Patienten mit einer antiresorptiven medikamentösen Osteoporose-Therapie besonders wichtig.
Vor allem bei einer Anwendung von parenteralen Antiresorptiva ist eine tägliche Gesamtzufuhr von mindestens 1.000 mg Calcium und eine ausreichende Versorgung mit Vitamin D ggf. durch eine adäquate Vortherapie mit Calcium und Vitamin D sicherzustellen, gleiches gilt bei einer Therapie mit dem Osteoanabolikum Romosozumab, das auch eine antiresorptive Wirkung insbesondere in den ersten Monaten ausübt.
Bei der Anwendung von Denosumab in Osteoporose-Dosierung (Dawson-Hughes B et al. 1990 📖Dawson-Hughes B, Dallal GE, Krall EA, Sadowski L, Sahyoun N, Tannenbaum S. A controlled trial of the effect of calcium supplementation on bone density in postmenopausal women. N Engl J Med 1990 Sep 27;323(13):878-83 Evidenzgrad 1++ SIGN) und bei parenteralen Bisphosphonaten (Reid IR et al. 1995 📖Reid IR, Horne AM, Mihov B, Stewart A, Garratt E, Wiessing KR, Bolland MJ, Bastin S, Gamble GD. Anti-fracture efficacy of zoledronate in subgroups of osteopenic postmenopausal women: secondary analysis of a randomized controlled trial. J Intern Med. 2019 Aug;286(2):221-229. doi: 10.1111/joim.12901. Epub 2019 Apr 8. PMID: 30887607.) sind selten Fälle von schweren Hypokalzämien bei Patientinnen und Patienten mit einer Neigung zu Hypokalzämien beschrieben. Eine Hypokalzämie ist bei der Anwendung von Bisphosphonaten und Denosumab eine Kontraindikation (s. auch Kapitel 9.5.4).
Die Sicherstellung der Vitamin D-Versorgung erfordert auch eine entsprechende Ernährungsberatung bzw. Überprüfung der Adhärenz bezüglich der Umsetzung einschließlich verordneter Medikamente.
Unter www.gesundheitsinformation.de findet sich ein Calciumrechner, mit dem die Calciumversorgung durch die Ernährung abgeschätzt werden kann.
Die 25-Hydroxy-Vitamin D3-Serumkonzentration war in zwei Beobachtungsstudien auch mit der Frakturrate bzw. Änderungen der Knochendichte unter einer antiresorptiven medikamentösen Osteoporose-Therapie assoziiert (Carmel AS et al. 2012 📖Carmel AS, Shieh A, Bang H, Bockman RS. The 25(OH)D level needed to maintain a favorable bisphosphonate response is ≥33 ng/ml. Osteoporos Int. 2012; Oct;23(10):2479-87. doi: 10.1007/s00198- 011-1868-7. Epub 2012 Jan 12. Evidenzgrad 3+ SIGN, Díez-Pérez A et al. 2012 📖Díez-Pérez A, Marin F, Eriksen EF, Kendler DL, Krege JH, Delgado-Rodríguez M. Effects of teriparatide on hip and upper limb fractures in patients with osteoporosis: A systematic review and meta-analysis. Bone. 2019 Mar;120:1-8. doi: 10.1016/j.bone.2018.09.020. Epub 2018 Sep 27. PMID: 30268814.)
Die gleichzeitige Einnahme von Calcium und Vitamin D kann das Frakturrisiko für Hüftfrakturen und auch alle anderen Frakturen senken. Die Vorteile der Therapie sollten gegenüber den möglichen Risiken, wie z. B. Nierensteine oder Nierenerkrankungen, Magen- Darm-Erkrankungen oder auch Herzerkrankungen, abgewogen werden.
| Empfehlung | |
|
Die Vitamin D-Supplementierung soll, bei einer generell empfohlenen Tagesdosis von 800 IE Cholecalciferol, 2.000-4.000 IE Cholecalciferol nicht überschreiten.
|
Grad der Empfehlung A |
| Güte der Evidenz 1 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz: Liu C, Kuang X, Li K, Guo X, Deng Q, Li D. Effects of combined calcium and vitamin D supplementation on osteoporosis in postmenopausal women: a systematic review and meta-analysis of randomized controlled trials. Food Funct 2020; 11: 10817 LoE 1Dai, Z.; McKenzie, J.E.; McDonald, S.; Baram, L.; Page, M.J.; Allman-Farinelli, M.; Raubenheimer, D.; Bero, L.A. Assessment of the Methods Used to Develop Vitamin D and Calcium Recommendations-A Systematic Review of Bone Health Guidelines. Nutrients 2021, 13, doi:10.3390/nu13072423. Keine Bewertung nach OXFORD möglich |
|
| Empfehlung | |
|
Im Falle einer Bolusgabe soll die Höhe der maximalen Einzeldosis 20000 I.E. nicht überschreiten.
|
Grad der Empfehlung A |
| Güte der Evidenz Expertenkonsens |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz:
Mazess, Richard B., Heike A. Bischoff‐Ferrari, and Bess Dawson‐Hughes. “Vitamin D: bolus is bogus—a narrative review.” JBMR plus 5.12 (2021): e10567. Keine Bewertung nach OXFORD möglich |
|
Bezüglich der Dosierung und der Toxizität von Vitamin D (hier Cholecalciferol) wurden in den letzten 10 Jahren sehr viele neue Erkenntnisse gewonnen. In den Jahrzehnten zuvor waren für die Therapie des Vitamin D-Mangels und der kindlichen Rachitis teilweise sehr hohe Einzeldosierungen verwendet worden (Bilezikian, J.P. et al. 2021 📖Bilezikian, J.P.; Formenti, A.M.; Adler, R.A.; Binkley, N.; Bouillon, R.; Lazaretti-Castro, M.; Marcocci, C.; Napoli, N.; Rizzoli, R.; Giustina, A. Vitamin D: Dosing, levels, form, and route of administration: Does one approach fit all? Rev Endocr Metab Disord 2021, 22, 1201-1218, doi:10.1007/s11154-021-09693-7.). Die zugrunde liegende Vorstellung war, dass die Verabreichung eines Hormonvorläufers ausreichend durch die systemische und die lokale Kapazität der 1alpha-Hydroxylase kontrolliert würde und nicht zu einer übermäßigen Hormonaktivierung führen würde und Toxizitätsprobleme, wie z. B. eine Hyperkalziämie oder andere nicht gewünschte Nebenwirkungen, verhindern würde.
Neuere Studien haben allerdings überraschend ergeben, dass die Verabreichung einer hohen Einzeldosis (300.000-500.000 U) zur Supplementation beim älteren Menschen einen Anstieg von Stürzen und Frakturen bedingte (Sanders K.M. et al. 2010 📖Sanders, K.M.; Stuart, A.L.; Williamson, E.J.; Simpson, J.A.; Kotowicz, M.A.; Young, D.; Nicholson, G.C. Annual high-dose oral vitamin D and falls and fractures in older women: a randomized controlled trial. JAMA 2010, 303, 1815-1822, doi:10.1001/jama.2010.594. Evidenzgrad 1++ SIGN; Smith H. 2007 📖Smith, H.; Anderson, F.; Raphael, H.; Maslin, P.; Crozier, S.; Cooper, C. Effect of annual intramuscular vitamin D on fracture risk in elderly men and women–a population-based, randomized, double-blind, placebo-controlled trial. Rheumatology (Oxford) 2007, 46, 1852-1857, doi:10.1093/rheumatology/kem240.). Diese Studien betreffen die Supplemente in der Population der Osteoporose-Patientinnen und -Patienten. Bei Empfehlungen zur Therapie der Rachitis werden nach wie vor auch hohe Dosierungen nicht als obsolet angesprochen, wenngleich auf dem Hintergrund, der bei der Osteoporose und im hohen Alter erhobenen Befunde auch hier eine kritische Überprüfung stattfinden sollte (Bilezikian, J.P. et al. 2021 📖Bilezikian, J.P.; Formenti, A.M.; Adler, R.A.; Binkley, N.; Bouillon, R.; Lazaretti-Castro, M.; Marcocci, C.; Napoli, N.; Rizzoli, R.; Giustina, A. Vitamin D: Dosing, levels, form, and route of administration: Does one approach fit all? Rev Endocr Metab Disord 2021, 22, 1201-1218, doi:10.1007/s11154-021-09693-7.).
Erklärungen aus der Pathophysiologie können darin bestehen, dass eine anhaltende Aktivierung der Vorläufer in der Zielzelle zu einer langdauernden Hochregulation der 24-Hydroxylase führen, die neu aktiviertes Vitamin D-Hormon sofort wieder inaktiviert und damit gewünschte Effekte blockiert. Cholecalciferol selbst hat wohl auch in der Zelle mehr eigene Wirkungen, als bis dato ins Kalkül gezogen wurden, die an der Vermittlung unerwünschter Wirkungen beteiligt sein könnten (Mazess R.B. et al. 2021 📖Mazess, Richard B., Heike A. Bischoff‐Ferrari, and Bess Dawson‐Hughes. “Vitamin D: bolus is bogus—a narrative review.” JBMR plus 5.12 (2021): e10567.).
Die aktuellen Empfehlungen zu Vitamin D durch das Institute of Medicine, die Deutsche Gesellschaft für Ernährung, die Endocrine Society und die Osteoporosis Foundation IOF lauten, dass unter einer Supplementation mit 800 U/die beim über 65-jährigen Menschen in 97 % der Betroffenen ein Vitamin D-Mangel korrigiert werden kann (Bischoff-Ferrari H.A. 2020 📖Bischoff-Ferrari HA, Freystätter G, Vellas B, Dawson-Hughes B, Kressig RW, Kanis JA, Willett WC, Manson JE, Rizzoli R, Theiler R, Hofbauer LC, Armbrecht G, da Silva JAP, Blauth M, de Godoi Rezende Costa Molino C, Lang W, Siebert U, Egli A, Orav EJ, Wieczorek M; DO-HEALTH Research Group. Effects of vitamin D, omega-3 fatty acids, and a simple home strength exercise program on fall prevention: the DO-HEALTH randomized clinical trial. Am J Clin Nutr. 2022 May 1;115(5):1311-1321. doi: 10.1093/ajcn/nqac022.PMID: 35136915). Für die hier angesprochene Klientel ist die tägliche, maximal die zweiwöchentliche kumulative Dosierung der beabsichtigten Tagesdosis empfohlen.
Bezüglich Toxizität kann festgestellt werden, dass die oberste Grenze des Normalbereiches im Serum bei 250 nMol/l 25-OH-D3 (100 ng/ml) angesetzt ist, und dass diese Grenze Sicherheit gibt. Die Grenze zur Toxizität wird in der Literatur mit 750 nMol/l (300 ng/ml) angesetzt, sodass die genannte Grenze auch noch genügend Sicherheitsabstand einräumt (Jones G. 2008 📖Jones, G. Pharmacokinetics of vitamin D toxicity. Am J Clin Nutr 2008, 88, 582S-586S, doi:10.1093/ajcn/88.2.582S.). In einer Sammlung von Kasuistiken wird der bei Personen mit klinischen Intoxikationszeichen gemessene Serumspiegel für 25-OH-D3 allerdings bereits im Bereich 150 bis 1220 ng/ml angegeben, sodass eher eine konservative Festlegung dieser Grenze angezeigt scheint (Galior K. et al. 2018 📖Galior, K.; Grebe, S.; Singh, R. Development of Vitamin D Toxicity from Overcorrection of Vitamin D Deficiency: A Review of Case Reports. Nutrients 2018, 10, doi:10.3390/nu10080953.). Die obere Grenze von 150 ng/ml wird auch in verschiedenen Leitlinien angegeben und erscheint sinnvoll (Marcinowska-Suchowierska E. et al. 2018 📖Marcinowska-Suchowierska, E.; Kupisz-Urbanska, M.; Lukaszkiewicz, J.; Pludowski, P.; Jones, G. Vitamin D Toxicity-A Clinical Perspective. Front Endocrinol (Lausanne) 2018, 9, 550, doi:10.3389/fendo.2018.00550.). Abhängig von der individuellen Vitamin D-Sensitivität (individuelle Aktivität der metabolisierenden Enzyme 1a- und 24-Hydroxylase) wurden bereits bei Dosen über 6.000 U/die über einen längeren Zeitraum Intoxikationen berichtet. Konservative Empfehlungen in der Literatur gehen dahin, dass eine tägliche Zufuhr von 2.000 U nicht überschritten werden sollten, bei dokumentierten Aufnahmestörungen liegen die höchsten Empfehlungen bei 4.000 U/die (Dai Z. et al. 2021 📖Dai, Z.; McKenzie, J.E.; McDonald, S.; Baram, L.; Page, M.J.; Allman-Farinelli, M.; Raubenheimer, D.; Bero, L.A. Assessment of the Methods Used to Develop Vitamin D and Calcium Recommendations-A Systematic Review of Bone Health Guidelines. Nutrients 2021, 13, doi:10.3390/nu13072423.; Kimball S.M et al. 2020 📖Kimball, S.M.; Holick, M.F. Official recommendations for vitamin D through the life stages in developed countries. Eur J Clin Nutr 2020, 74, 1514-1518, doi:10.1038/s41430-020-00706-3.).
Für eine ausreichende Versorgung mit Vitamin K ist zu sorgen, so wie auch für die ausreichende Versorgung mit Vitamin B und Folsäure, wie es in den Leitlinien des DVO als Empfehlung verankert ist. Darüber hinaus kann auch unter dem Gesichtspunkt der Therapiekosten bei dem derzeitigen Stand der Evidenz keine Empfehlung zur generellen Substitution bei Osteoporose ausgesprochen werden.
| Empfehlung | |
|
Vitamin K2 soll nicht zur spezifischen Therapie der Osteoporose verwendet werden. Rønn, S. H., Harsløf, T., Pedersen, S. B., & Langdahl, B. L. (2016). Vitamin K2 (menaquinone-7) prevents age-related deterioration of trabecular bone microarchitecture at the tibia in postmenopausal women. European journal of endocrinology, 175(6), 541-549.LoE2 |
Grad der Empfehlung A |
| Güte der Evidenz 2 |
|
| Konsensstärke 16/16 1 Enthaltung Starker Konsens |
|
| Empfehlung | |
|
Ein Vitamin K Mangel, der insbesondere bei chronisch Kranken vorkommt, sollte unter Beachtung von Wechselwirkungen mit Vitamin K Antagonisten, ausgeglichen werden.
|
Grad der Empfehlung B |
| Güte der Evidenz Expertenkonsens |
|
| Konsensstärke 16/17 keine Enthaltung 94% Konsens |
|
Vitamin K ist ein Sammelbegriff für verschiedene fettlösliche Moleküle mit unterschiedlicher Wirkung und Pharmakologie, deren physiologische Bedeutung im Bereich der Blutgerinnung, der geordneten Mineralisierung des Skeletts und der Verhinderung von Verkalkung wichtiger Strukturen und Geweben liegt (Simes D.C. et al. 2020 📖Simes, D.C.; Viegas, C.S.B.; Araujo, N.; Marreiros, C. Vitamin K as a Diet Supplement with Impact in Human Health: Current Evidence in Age-Related Diseases. Nutrients 2020, 12, doi:10.3390/nu12010138.; Saito T. et al. 2020 📖Saito M, Moore-Lotridge SN, Uppuganti S, Egawa S, Yoshii T, Robinette JP, Posey SL, Gibson BHY, Cole HA, Hawley GD, Guelcher SA, Tanner SB, McCarthy JR, Nyman JS, Schoenecker JG. Determining the pharmacologic window of bisphosphonates that mitigates severe injury-induced osteoporosis and muscle calcification, while preserving fracture repair. Osteoporos Int. 2022 Apr;33(4):807-820. doi: 10.1007/s00198-021-06208-7. Epub 2021 Oct 31. PMID: 34719727.; Mandatori D. et al. 2021 📖Mandatori, D.; Pelusi, L.; Schiavone, V.; Pipino, C.; Di Pietro, N.; Pandolfi, A. The Dual Role of Vitamin K2 in “Bone-Vascular Crosstalk”: Opposite Effects on Bone Loss and Vascular Calcification. Nutrients 2021, 13, doi:10.3390/nu13041222.; Popa D.S. et al. 2021 📖Popa, D.S.; Bigman, G.; Rusu, M.E. The Role of Vitamin K in Humans: Implication in Aging and Age-Associated Diseases. Antioxidants (Basel) 2021, 10, doi:10.3390/antiox10040566.; Mladenka P. et al. 2021 📖Mladenka, P.; Macakova, K.; Kujovska Krcmova, L.; Javorska, L.; Mrstna, K.; Carazo, A.; Protti, M.; Remiao, F.; Novakova, L.; researchers, O., et al. Vitamin K – sources, physiological role, kinetics, deficiency, detection, therapeutic use, and toxicity. Nutr Rev 2021, 10.1093/nutrit/nuab061, doi:10.1093/nutrit/nuab061.; Stock M. et al. 2021 📖Stock JL. The effect of teriparatide compared with risedronate on reduction of back pain in postmenopausal women with osteoporotic vertebral fractures. Osteoporos Int. 2012 Aug;23(8):2141-50. doi: 10.1007/s00198-011-1856-y. Epub 2011 Dec 13. PMID: 22159672.
). Vitamin K1, Phylloquinon, ist das eigentliche Vitamin K, das aus der Nahrung aufgenommen wird und Auswirkungen auf die Aktivität von g -Carboxylase und g-Carboxylierung von Proteinen und damit deren Funktion hat. Vitamin K-abhängige Proteine VKDP erfüllen multiple Funktionen, hauptsächlich in der Blutgerinnung und in der geordneten Mineralisierung (im Knochen) und in der pathologischen Verkalkung von Geweben (Arteriosklerose). Vitamin K2, Menaquinon, steht für eine Reihe von Abkömmlingen mit längeren Seitenketten, die durch Fermentieren von Nahrungsmitteln und/oder durch Aktivität des Mikrobioms im Darm entstehen. Sie haben eine andere Pharmakologie und benötigen möglicherweise eine getrennte ernährungsphysiologische Behandlung.
Vitamin K-abhängige Proteine im Knochen haben nach präklinischen Untersuchungen eher einen Einfluss auf die geordnete Mineralisierung und wirken eher hemmend auf die ungezielte Verkalkung (was plausibel ist mit der Verhinderung von Arteriosklerose-Verkalkungen). Funktionell wird der Knochen z. B. bei Osteocalcin-Mangel eher brüchiger trotz unveränderter oder sogar erhöhter BMD (Sato T. et al. 2020 📖M. Sato, M. Tsujimoto, K. Kajimoto, H. Uetake, H. Shimoda and S. Fujiwara. Effect of a patient-support program on once-daily teriparatide adherence and persistence in the Japan Fracture Observational Study (JFOS). Arch Osteoporos 2018 Vol. 13 Issue 1 Pages 74; Mandatori D. et al. 2021 📖Mandatori, D.; Pelusi, L.; Schiavone, V.; Pipino, C.; Di Pietro, N.; Pandolfi, A. The Dual Role of Vitamin K2 in “Bone-Vascular Crosstalk”: Opposite Effects on Bone Loss and Vascular Calcification. Nutrients 2021, 13, doi:10.3390/nu13041222.; Stock M. et al. 2021 📖Stock JL. The effect of teriparatide compared with risedronate on reduction of back pain in postmenopausal women with osteoporotic vertebral fractures. Osteoporos Int. 2012 Aug;23(8):2141-50. doi: 10.1007/s00198-011-1856-y. Epub 2011 Dec 13. PMID: 22159672).
Vitamin K-Mangel ist labortechnisch schwierig nachzuweisen, in Zukunft werden HPLC-basierte und Massenspektrometrische Untersuchungen zur Verfügung stehen. Derzeit wird der Vitamin-K-Status durch Bestimmung untercarboxylierter Proteine nachgewiesen, wie z.B. Osteocalcin oder Matrix-Gla-Protein. Die untercarboxylierten Proteine sinken unter einer Substitutionstherapie ab (Zhang Y. et al. 2019 📖Zhang H, Xu C, Zhang T, et al. Does percutaneous vertebroplasty or balloon kyphoplasty for osteoporotic vertebral compression fractures increase the incidence of new vertebral fractures? A meta-analysis. Pain Physician. 2017 Jan-Feb;20(1):E13-E28. Evidenzlevel OXFORD 2; Fusaro M. et al. 2017 📖Fusaro, M.; Gallieni, M.; Rizzo, M.A.; Stucchi, A.; Delanaye, P.; Cavalier, E.; Moyses, R.M.A.; Jorgetti, V.; Iervasi, G.; Giannini, S., et al. Vitamin K plasma levels determination in human health. Clin Chem Lab Med 2017, 55, 789-799, doi:10.1515/cclm-2016-0783.).
Die empfohlene tägliche Zufuhr für Vitamin K ist 1 µg/kg KG. Die Bioverfügbarkeit ist extrem von der Nahrungsmittelmatrix und der Verfügbarkeit von Fett abhängig. Die Toxizität hoher Dosen ist verschwindend gering (Simes D.C. et al. 2020 📖Simes, D.C.; Viegas, C.S.B.; Araujo, N.; Marreiros, C. Vitamin K as a Diet Supplement with Impact in Human Health: Current Evidence in Age-Related Diseases. Nutrients 2020, 12, doi:10.3390/nu12010138.; Mladenka P. et al. 2021 📖Mladenka, P.; Macakova, K.; Kujovska Krcmova, L.; Javorska, L.; Mrstna, K.; Carazo, A.; Protti, M.; Remiao, F.; Novakova, L.; researchers, O., et al. Vitamin K – sources, physiological role, kinetics, deficiency, detection, therapeutic use, and toxicity. Nutr Rev 2021, 10.1093/nutrit/nuab061, doi:10.1093/nutrit/nuab061.). Vitamin K-Mangel ist, gemessen an den funktionellen Assays, häufig und beträgt bis zu 30 % der Bevölkerung, bis zu 50 % bei den chronischen Kranken (Diabetes, Rheuma, Hypertonie) (Mladenka P. et al. 2021 📖Mladenka, P.; Macakova, K.; Kujovska Krcmova, L.; Javorska, L.; Mrstna, K.; Carazo, A.; Protti, M.; Remiao, F.; Novakova, L.; researchers, O., et al. Vitamin K – sources, physiological role, kinetics, deficiency, detection, therapeutic use, and toxicity. Nutr Rev 2021, 10.1093/nutrit/nuab061, doi:10.1093/nutrit/nuab061.; Riphagen I.J. et al. 2017 📖Riphagen, I.J.; Keyzer, C.A.; Drummen, N.E.A.; de Borst, M.H.; Beulens, J.W.J.; Gansevoort, R.T.; Geleijnse, J.M.; Muskiet, F.A.J.; Navis, G.; Visser, S.T., et al. Prevalence and Effects of Functional Vitamin K Insufficiency: The PREVEND Study. Nutrients 2017, 9, doi:10.3390/nu9121334.).
Die klinische Bedeutung einer Unterversorgung in Bezug auf kardiovaskuläre Endpunkte und Fraktur-Inzidenz wurde in Assoziations-Studien untersucht. Viele Untersuchungen stammen aus dem Bereich der Versorgung von Patientinnen und Patienten mit chronischer Niereninsuffizienz (CKD) (Shea M.K. et al. 2021 📖Shea, M. Kyla, et al. “Vitamin K status, all-cause mortality, and cardiovascular disease in adults with chronic kidney disease: the Chronic Renal Insufficiency Cohort.” The American journal of clinical nutrition 115.3 (2022): 941-948.). Relativ sichere Ergebnisse zeigen einen Zusammenhang zwischen Gesamt-Mortalität und kardiovaskulärer Mortalität und niedriger Vitamin K-Zufuhr respektive niedrigem Vitamin K-Status (Simes D.C. et al. 2020 📖Simes, D.C.; Viegas, C.S.B.; Araujo, N.; Marreiros, C. Vitamin K as a Diet Supplement with Impact in Human Health: Current Evidence in Age-Related Diseases. Nutrients 2020, 12, doi:10.3390/nu12010138.; Zhang S. et al. 2019 📖Zhang, Z. F., Yang, J. L., Jiang, H. C., Lai, Z., Wu, F., & Liu, Z. X. (2017). Updated association of tea consumption and bone mineral density: A meta-analysis. Medicine, 96(12).2; Mayer O. et al. 2021 📖Mayer, O.; Bruthans, J.; Seidlerova, J.; Gelzinsky, J.; Kucera, R.; Karnosova, P.; Materankova, M.; Rychecka, M.; Wohlfahrt, P.; Cifkova, R., et al. Low vitamin K status, high sclerostin and mortality risk of stable coronary heart disease patients. Biomark Med 2021, 15, 1465-1477, doi:10.2217/bmm-2021-0168.; Palmer C.R. et al. 2021 📖Palmer, C.R.; Bellinge, J.W.; Dalgaard, F.; Sim, M.; Murray, K.; Connolly, E.; Blekkenhorst, L.C.; Bondonno, C.P.; Croft, K.D.; Gislason, G., et al. Association between vitamin K1 intake and mortality in the Danish Diet, Cancer, and Health cohort. Eur J Epidemiol 2021, 36, 1005-1014, doi:10.1007/s10654-021-00806-9.). Interventionsstudien mit Vitamin K-Abkömmlingen in diesem Bereich konnten keine konsistente Reduktion dieser Mortalität nachweisen und sind kritisch zu betrachten (Shea M.K. et al. 2021 📖Shea, M. Kyla, et al. “Vitamin K status, all-cause mortality, and cardiovascular disease in adults with chronic kidney disease: the Chronic Renal Insufficiency Cohort.” The American journal of clinical nutrition 115.3 (2022): 941-948.).
Klinische Assoziationsstudien mit der Vitamin K-Zufuhr und dem Auftreten von Frakturen leiden unter der Heterogenität der untersuchten Gruppen, der Heterogenität verabreichter Supplemente und unter der variablen Verwendung von Surrogatparametern und beispielsweise Frakturnachweisen ausschließlich durch Befragung. Insgesamt sind die Ergebnisse von Metaanalysen nicht überzeugend und berichten bestenfalls Trends in Richtung Verbesserung von Surrogat-Parametern, am häufigsten genannt hier die LWS BMD (Hu L. et al. 2021 📖Hu, L.; Ji, J.; Li, D.; Meng, J.; Yu, B. The combined effect of vitamin K and calcium on bone mineral density in humans: a meta-analysis of randomized controlled trials. J Orthop Surg Res 2021, 16, 592, doi:10.1186/s13018-021-02728-4.).
Interventionsstudien mit Vitamin K1 Supplementen wurden in viel diskutierten Metaanalysen zusammengefasst, die bis zu 36 Studien einschlossen, mit dem Ergebnis, dass ein Effekt nicht auszuschließen aber auch nicht nachzuweisen sei. Die meisten eingeschlossenen Studien wiesen erhebliche qualitative Mängel auf und die Ergebnisse waren inkonsistent (Mott A. et al. 2019 📖Mott, A.; Bradley, T.; Wright, K.; Cockayne, E.S.; Shearer, M.J.; Adamson, J.; Lanham-New, S.A.; Torgerson, D.J. Effect of vitamin K on bone mineral density and fractures in adults: an updated systematic review and meta-analysis of randomised controlled trials. Osteoporos Int 2019, 30, 1543-1559, doi:10.1007/s00198-019-04949-0.; Mott A. et al. 2020 📖Mott, A.; Bradley, T.; Wright, K.; Cockayne, E.S.; Shearer, M.J.; Adamson, J.; Lanham-New, S.A.; Torgerson, D.J. Correction to Effect of vitamin K on bone mineral density and fractures in adults: an updated systematic review and meta-analysis of randomised controlled trials. Osteoporos Int 2020, 31, 2269-2270, doi:10.1007/s00198-020-05586-8.).
Therapiestudien mit Vitamin K2 erbrachten ebenfalls inkonsistente Ergebnisse. Eine Metaanalyse von 19 Studien aus dem Jahr 2015 fasst klinisch unveränderte Knochendichtewerte und fehlende Wirkung auf die Frakturrate zusammen, ein Ergebnis, zu dem auch eine zweite Metaanalyse aus 2019 kommt, die aus 18 eingeschlossenen RCTs keine signifikante Wirkung auf die Frakturrate erkennen konnte (Su S. et al. 2021 📖S. Shorey and V. Chan. Women Living With Osteoporosis: A Meta-Synthesis. Gerontologist 2021 Vol. 61 Issue 3 Pages e39-e47; Su S. et al. 2019).
Eine Studie unter der Leitung von Bente Langdahl konnte in der Knochenhistologie einen erhaltenden Effekt für die Mikrostruktur des Knochens durch 375 µg/die Vitamin K2 nachweisen. Eine Folgestudie aus der gleichen Arbeitsgruppe konnte in osteopenischen postmenopausalen Frauen unter Verwendung von DXA and HRpQCT keinen Unterschied feststellen (Ronn S.H. et al. 2016 📖Ronn, S.H.; Harslof, T.; Pedersen, S.B.; Langdahl, B.L. Vitamin K2 (menaquinone-7) prevents age-related deterioration of trabecular bone microarchitecture at the tibia in postmenopausal women. Eur J Endocrinol 2016, 175, 541-549, doi:10.1530/EJE-16-0498.; Ronn S.H. et al. 2021 📖Ronn, S.H.; Harslof, T.; Oei, L.; Pedersen, S.B.; Langdahl, B.L. The effect of vitamin MK-7 on bone mineral density and microarchitecture in postmenopausal women with osteopenia, a 3-year randomized, placebo-controlled clinical trial. Osteoporos Int 2021, 32, 185-191, doi:10.1007/s00198-020-05638-z.). Andere Studien beschäftigten sich mit der Frage der additiven Wirkung zwischen Bisphosphonaten und Vitamin K sowie mit der additiven Wirkung zwischen Vitamin K und osteologischer Basistherapie mit Vitamin D und Calcium, dies erneut mit inkonsistenten Ergebnissen. Es existieren keine prospektiven RCT-Daten mit klinischen Endpunkten, wie Frakturen.
In Schlussfolgerung daraus bleibt zu konstatieren, dass ein Vitamin K-Mangel ausgeglichen werden sollte, wobei zur besseren und einfacheren Diagnose zukünftige Etablierung von verlässlichen Labormethoden abgewartet werden müssen.
Eine diätetische Empfehlung an die klinisch relevanten Gruppen der Risikopopulation chronisch Kranker ist zu empfehlen. Hierbei sind Dosierungen bis zu maximal 375 µg Vitamin K2 als wirksam für den Ausgleich des Mangels anzusehen, für die Supplementation gelten die Empfehlungen der Deutschen Gesellschaft für Ernährung. Die Beachtung der Fettlöslichkeit und der sehr variablen Bioverfügbarkeit ist dabei ein wichtiger Faktor. Es gibt derzeit keine genügend große Evidenz, um eine Therapie mit Vitamin K2 generell als frakturwirksame Therapie zu empfehlen, auch wenn die Therapie mit solchen Präparaten in Japan und einigen anderen asiatischen Ländern als Anti-Osteoporose-Therapie zugelassen ist.
Empfehlungen zur knochengesunden Ernährung werden im Kapitel Generelle Fraktur-und Osteoporoseprophylaxe formuliert. Generell sollte eine Mangelernährung, inklusive Eiweißunterernährung, möglichst vermieden werden.
In verschiedenen Studien wurde der Effekt von B-Vitaminen, Folsäure, Kalium und auch von Nahrungsmitteln, wie z. B. grünem Tee, untersucht. Ruan et al 📖Ruan, J., Gong, X., Kong, J., Wang, H., Zheng, X., & Chen, T. (2015). Effect of B vitamin (folate, B6, and B12) supplementation on osteoporotic fracture and bone turnover markers: a meta-analysis. Medical science monitor: international medical journal of experimental and clinical research, 21, 875. Evidenzgrad 1- SIGN. gingen in einer Metaanalyse der Frage nach dem Effekt von B-Vitaminen und Folsäure auf das Frakturrisiko und der Knochenumbaumarker nach. Die Autoren konnten keinen Effekt der Therapie bei Patientinnen und Patienten mit einer Gefäßerkrankung oder einem relativ normalen Plasma Homocysteinspiegel nachweisen (Ruan J. et al. 2015 📖Ruan, J., Gong, X., Kong, J., Wang, H., Zheng, X., & Chen, T. (2015). Effect of B vitamin (folate, B6, and B12) supplementation on osteoporotic fracture and bone turnover markers: a meta-analysis. Medical science monitor: international medical journal of experimental and clinical research, 21, 875. Evidenzgrad 1- SIGN).
Enneman et al. konnten in einer randomisierten, kontrollierten Studie keinen Effekt von Vitamin B12 und Folsäure bei älteren Patientinnen und Patienten mit einem erhöhten Homozysteinspiegel im Blut nachweisen. Lediglich bei Patientinnen und Patienten mit einem Alter >80 Jahre konnte in der quantitativen Ultraschallmessung ein positiver Effekt gezeigt werden (Enneman A.W. et al. 2015 📖Enneman AW, Swart KM, van Wijngaarden JP, van Dijk SC, Ham AC, Brouwer-Brolsma EM, van der Zwaluw NL, Dhonukshe-Rutten RA, van der Cammen TJ, de Groot LC, van Meurs J, Lips P, Uitterlinden AG, Zillikens MC, van Schoor NM, van der Velde N. Effect of Vitamin B12 and Folic Acid Supplementation on Bone Mineral Density and Quantitative Ultrasound Parameters in Older People with an Elevated Plasma Homocysteine Level: B-PROOF, a Randomized Controlled Trial. Calcif Tissue Int. 2015 May;96(5):401-9. doi: 10.1007/s00223-015-9968-6. Epub 2015 Feb 25. Evidenzgrad 1- SIGN).
Lambert und Mitarbeiter konnten für die Supplementierung mit Kalium in einer Metaanalyse zwar nachweisen, dass signifikant die renale Calcium- und Säureausscheidung reduziert wird und die Knochenabbaumarker ebenfalls sinken (Lambert H. et al. 2015 📖Lambert H, Frassetto L, Moore JB, Torgerson D, Gannon R, Burckhardt P, Lanham-New S. The effect of supplementation with alkaline potassium salts on bone metabolism: a meta- analysis.Osteoporos Int. 2015 Apr;26(4):1311-8. doi: 10.1007/s00198-014-3006-9. Epub 2015 Jan 9. Evidenzgrad 2- SIGN). Positive Effekte auf das Frakturrisiko oder die Knochengesundheit können zwar vermutet werden, wurden aber bisher in der vorliegenden Literatur nicht nachgewiesen.
Xiang et al. zeigten in einer 2019 publizierten Metaanalyse einen Zusammenhang zwischen Konsum von grünem Tee und der Reduktion des Frakturrisikos (höchster vs. niedrigster Konsum RR 0,86, 95 % CI 0,78-0,94), was die Evidenz publizierter Daten zur positiven Beeinflussung der Knochendichte ergänzt (Zhang et al 2017 📖Zhang, Z. F., Yang, J. L., Jiang, H. C., Lai, Z., Wu, F., & Liu, Z. X. (2017). Updated association of tea consumption and bone mineral density: A meta-analysis. Medicine, 96(12).2).
| Empfehlung | |
|
Ein Programm zur Verbesserung von Kraft, Balance und Koordination soll im Rahmen der Osteoporose-Therapie durchgeführt werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz:
Zhao R et al. Exercise interventions and prevention of fall-related fractures in older people: a meta-analysis of randomized controlled trails. Int J Epidemiol 2017; 46: 149-161. OXFORD 1 |
|
Die vorliegende Literatur belegt einen positiven Effekt von Training und körperlicher Aktivität auf das Auftreten von Stürzen und sturzbedingten Frakturen bei älteren Menschen (Zhao R. et al. 2017 📖Zhao S, Xu CY, Zhu AR, et al. Comparison of the efficacy and safety of 3 treatments for patients with osteoporotic vertebral compression fractures: a network meta-analysis. Medicine (Baltimore). 2017 Jun;96(26):e7328.). Körperliches Training zeigt außerdem einen Effekt auf die Muskelkraft und den Körperfettanteil bei bestimmten Trainingsformen (Chan D.C. et al. 2017 📖Chan, D. C., Chang, C. B., Han, D. S., Hong, C. H., Hwang, J. S., Tsai, K. S., & Yang, R. S. (2018). Effects of exercise improves muscle strength and fat mass in patients with high fracture risk: a randomized control trial. Journal of the Formosan Medical Association, 117(7), 572-582.OXFORD 2). Ferner besteht 1++ Evidenz, dass die Knochendichte bei postmenopausalen Frauen durch körperliches Training verbessert werden kann (Zhao R. et al. 2017 📖Zhao, R., Feng, F., & Wang, X. (2017). Exercise interventions and prevention of fall-related fractures in older people: a meta-analysis of randomized controlled trials. International journal of epidemiology, 46(1), 149-161 OXFORD 1; Shojaa et al. 2020 📖Shojaa, von Stengel, Kohl, Schoene, Kemmler (2020): Effects of dynamic resistance exercise on bone mineral density in postmenopausal women: a systematic review and meta-analysis with special emphasis on exercise parameters. Osteoporosis International 31:1427–1444 https://doi.org/10.1007/s00198-020-05441-w ). Bei Männern hingegen konnte die aktuellste Evidenz (Stärke 2+) aus einer systematischen Review ohne Metaanalyse (Kemmler et al. 2018 📖Kemmler, Shojaa, Kohl, von Stengel (2018): Exercise effects on bone mineral density in older men: a systematic review with special emphasis on study interventions. Osteoporosis International (2018) 29:1493–1504 https://doi.org/10.1007/s00198-018-4482-0 ) nicht eindeutig auf einen positiven Effekt auf Knochendichte bei älteren Männern hinweisen.
Generell sollte ein Programm zum körperlichen Training bzw. Steigerung von körperlicher Aktivität bei älteren Menschen zur Osteoporose-Behandlung sowie Sturz- und Frakturprophylaxe eingesetzt werden. Wichtig ist dabei eine Anpassung an den funktionellen Status, um potenzielle Risiken durch Bewegungsprogramme oder körperliche Aktivität zu vermeiden.
An dieser Stelle wird auf die angemeldete S3 Leitlinie Körperliches Training zur Frakturprophylaxe des DVO mit geplanter Fertigstellung Juni 2023 verwiesen.
| Empfehlung | |
|
Die Häufigkeit der Wiederholung von Knochendichtemessungen sollte sich ohne spezifische Therapie an der Ausgangsknochendichte orientieren, insbesondere an der Wahrscheinlichkeit, innerhalb des Messintervalls die Interventionsschwelle bezüglich einer spezifischen Therapie zu überschreiten.
|
Empfehlungsgrad B |
| Evidenzgrad 1b |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz:
Gourlay ML1, Fine JP, Preisser JS, May RC, Li C, Lui LY, Ransohoff DF, Cauley JA, Ensrud KE; Study of Osteoporotic Fractures Research Group. Bone-density testing interval and transition toosteoporosis in older women. N Engl J Med. 2012; Jan 19;366(3):225-33 Evidenzgrad 1b Oxford |
|
Der Zeitpunkt einer Wiederholungsmessung der DXA-Knochendichte sollte sich bei Patientinnen und Patienten ohne eine spezifische Osteoporose-Therapie an dem Messwert der Vormessung orientieren (Gourlay ML et al. 2012 📖Gourlay ML1, Fine JP, Preisser JS, May RC, Li C, Lui LY, Ransohoff DF, Cauley JA, Ensrud KE; Study of Osteoporotic Fractures Research Group. Bone-density testing interval and transition to osteoporosis in older women. N Engl J Med. 2012; Jan 19;366(3):225-33 Evidenzgrad 1b Oxford). Wenn kein schneller Knochendichteverlust aufgrund einer veränderten klinischen Gesamtsituation zu vermuten ist (Beispiel: Hinzukommen neuer Frakturrisikofaktoren wie eine Prednisolontherapie), gelten die im folgenden Absatz ausgesprochenen Empfehlungen zum Abstand von Knochendichtekontrollen. Im Falle von zu erwartenden, rapiden Knochendichteverlusten sollten dem individuellen Risikoprofil der Patientin/des Patienten angepasste Knochendichtekontrollen vorgenommen werden. Dabei sollte der Zeitabstand von DXA-Wiederholungsmessungen ohne Therapie davon abhängig gemacht werden, welche Änderung des T-Scores therapierelevant wäre.
In der SOF-Studie betrug die mittlere Zeitspanne bis zum Erreichen einer spezifischen Therapieindikation nach Adjustierung, in der 10 % der teilnehmenden Frauen einen T-Score von < -2,5 am Schenkelhals oder Gesamtfemur erreichten, bei den Frauen mit einem Ausgangs- T-Score von -1,0 oder höher 16,8 Jahre, bei den Frauen mit einem Ausgangs T-Score von -1,5 bis -2,0 4,7 Jahre und bei einem Ausgangs T-Score von -2,0 bis -2,5 1,1 Jahre (Gourlay ML et al. 2012 📖Gourlay ML1, Fine JP, Preisser JS, May RC, Li C, Lui LY, Ransohoff DF, Cauley JA, Ensrud KE; Study of Osteoporotic Fractures Research Group. Bone-density testing interval and transition to osteoporosis in older women. N Engl J Med. 2012; Jan 19;366(3):225-33 Evidenzgrad 1b Oxford).
In Analogie zu den oben genannten Schätzwerten sollte eine erneute Messung bereits nach 12 Monaten erfolgen, wenn ein Absinken des T-Scores um 0,5 T- Scores therapierelevant wäre. Wenn eine Änderung von 1,0 T-Scores therapierelevant ist, sollte eine erneute Messung in der Regel nicht vor Ablauf von 2 Jahren erfolgen und sollte an das individuelle Risikoprofil adaptiert werden.
Bei T-Werten > -1,0 sind in der Regel Messintervalle >5 Jahre ausreichend. Das Messintervall >5 Jahre schließt auch längere Abstände mit ein. Da eine Risikofaktoren-getriggerte Basisdiagnostik in den Leitlinien empfohlen wird, ist jedoch aufgrund des vorliegenden Risikofaktorenprofils eine Wiederholung der Knochendichtemessung generell >5 Jahre anzudenken.
Kürzere Kontrollintervalle können bei Änderungen der Gesamtsituation notwendig werden (Beispiel: neu aufgetretene Begleiterkrankungen, neu eingeleitete Therapie mit Glucocorticoiden).
| Therapierelevanz T-Score Abnahme von |
Empfohlener Zeitpunkt erneuter DXA Messung nach Erstmessung |
| 0,5 SD T-Sore | 12 Monate |
| 1,0 SD T-Score | 2 Jahre |
| Bei T-Score Ergebnis > -1,0 SD | >5 Jahre |
Mit Verweis auf das Kapitel Medikamentöse Therapie und die dort getroffenen Aussagen zur Knochendichteschwelle ist Folgendes festzuhalten:
Die grundsätzliche Voraussetzung für die Verordnung von Präparaten zur Therapie ist die spezifische Zulassung des Medikaments für die jeweilige Indikation, das Fehlen von Kontraindikationen und die Beachtung der aktuellen Fachinformation.
Die spezifische Voraussetzung für die Verordnung einer medikamentösen Therapie bei Osteoporose ist das Vorliegen eines Frakturrisikos, das oberhalb berechneter Therapieschwellen für Wirbelkörper- und Schenkelhalsfrakturen liegt.
Bezugnehmend auf die Aussagen aus Kapitel 7, ist die Indikation zur Einleitung einer spezifischen Therapie auf Grundlage des neuen DVO-Modells zu begründen:
Das neue DVO-Modell ist dem alten sowie anderen verfügbaren Risikorechnern aufgrund der hervorragenden Referenzdatenlage, insbesondere für Männer, der systematischen Aufarbeitung der Literatur für alle in das Risikomodell eingeschlossenen Risikofaktoren sowie deren Überprüfung hinsichtlich Prävalenz und Frakturprädiktion in einem großen Krankenkassendatensatz einer deutschen Referenzpopulation der durchgeführten Analyse zu Interaktionen von Risikofaktoren der Beachtung des imminenten Frakturrisikos, dem nicht Einbeziehen der Mortalität aufgrund des Prädiktionszeitraumes von 3 Jahren somit der intensiven zugrundliegenden Datenanalyse vorzuziehen und die Indikationsstellung zur medikamentösen Therapie soll aus diesem Grund mit diesem Modell erfolgen entsprechend der kalkulierten Schwellenwerte.
| Empfehlung | |
|
Die Indikation zur Einleitung einer spezifischen Therapie soll auf Grundlage des berechneten Frakturrisikos nach neuem DVO-Modell und der empfohlenen Schwellenwerte erfolgen.
|
Empfehlungsgrad A |
| Evidenzgrad Expertenkonsens |
|
| Konsensstärke 19/19 Starker Konsens |
|
Die in früheren Leitlinienversionen diskutierte Knochendichte-Schwelle für die Effektivität medikamentöser Therapien wird fallen gelassen. In den alten Therapiestudien wurde als Einschlusskriterium die rein auf dem osteodensitometrischen Ergebnis einer DXA beruhende WHO-Definition der Osteoporose (T-Score <-2,5) verwendet. Mit diesem Einschlusskriterium bestand eine Unsicherheit bzgl. der therapeutischen Wirksamkeit bei T-Score Werten über >-2,5 SD. Bereits in der letzten Leitlinienversion 2017 wurde darauf hingewiesen, dass in neueren Therapiestudien auch für orale Bisphosphonate eine Wirksamkeit bei T-Scores zwischen -2,0 und -2,5 belegt wurde. Zudem lagen bereits 2017 Studien vor, die eine Wirksamkeit von oralen Bisphosphonaten und SERMs auch bei T-Score Werten über -2,0 SD nachwiesen. Mittlerweile hat sich diese Evidenz weiter erhärtet (s. Kapitel 9 Medikamentöse Therapie), die klare Evidenz dafür belegt, dass die Wirksamkeit der spezifischen medikamentösen Therapien unabhängig von einer Knochendichteschwelle ist. Daher wird bei Vorliegen einer Osteoporose mit absolutem Frakturrisiko oberhalb der DVO-Therapieschwelle eine spezifische medikamentöse Therapie unabhängig vom T-Score der Knochendichte empfohlen. Liegt der minimale DXA T-Score > -1,0 SD, so ist die Validität des Messwertes und des Messverfahrens wie die Diagnose Osteoporose sorgfältig zu hinterfragen.
Bei typischen osteoporotischen radiologischen und klinischen Aspekten von Wirbelkörperfrakturen kann, wenn andere Ursachen als eine bestehende Osteoporose nicht wahrscheinlicher sind, auf eine Knochendichtemessung verzichtet werden und eine medikamentöse Therapie ohne Vorliegen eines Knochendichteergebnisses eingeleitet werden. Wirbelkörperfrakturen sind mit einem hohen Folgefrakturrisiko verbunden. Es wird auf das Kapitel 9 „Medikamentöse Therapie“ und Risikofaktor Wirbelkörperfraktur 4.2.2. verwiesen.
| Empfehlung | |
|
Nach einer niedrigtraumatischen singulären Wirbelkörperfraktur
2. oder 3. Grades nach Genant (25-40 % bzw. >40 % Höhenminderung) oder niedrig-traumatischen multiplen Wirbelkörperfrakturen 1. bis 3. Grades nach Genant soll, wenn andere Ursachen einer Fraktur nicht wahrscheinlicher sind, individuell unabhängig vom Knochendichteergebnis eine medikamentöse Therapie empfohlen werden. |
Empfehlungsgrad A |
| Evidenzgrad 1 Kanis et al. 2005 SIGN 1++, Silvermann et al. 2008, SIGN 1++ |
|
| Konsensstärke 19/19 Starker Konsens |
|
| Empfehlung | |
|
Eine medikamentöse Therapie soll nach proximalen Femurfrakturen nach erfolgter Differenzialdiagnostik unabhängig vom Knochendichteergebnis empfohlen werden.
|
Empfehlungsgrad A |
| Evidenzgrad 2 Ryg, Jesper, et al. “Hip fracture patients at risk of second hip fracture: a nationwide population‐based cohort study of 169,145 cases during 1977–2001.” Journal of bone and mineral research 24.7 (2009): 1299-1307.LoE 2 |
|
| Konsensstärke 19/19 Starker Konsens |
|
Proximale Femurfrakturen sind mit einem hohen Folgefrakturrisiko verbunden (s. Kapitel Risikofaktor proximale Femurfraktur 4.2.1.). Dies gilt über alle Altersgrenzen hinweg. Aus diesem Grunde ist die Therapieschwelle nach proximaler Femurfraktur ohne massives Trauma als überschritten anzunehmen und eine medikamentöse Therapie zur Senkung des hohen Frakturrisikos unabhängig von einem Knochendichteergebnis rasch einzuleiten. Hinsichtlich der Therapie und deren Besonderheiten nach proximaler Femurfraktur wird auf das Kapitel medikamentöse Therapie verwiesen.
| Empfehlung | |
|
Eine medikamentöse Therapie soll bei einer Therapie mit oralen Glucocorticoiden bei postmenopausalen Frauen und Männern in einer Tagesdosis von ≥7,5 mg Prednisolonäquivalent angeboten werden:
– wenn diese bereits für 3 oder mehr Monate durchgeführt wurde oder bei Beginn der Therapie absehbar ist, dass die orale Glucocorticoid-Therapie länger als drei Monate andauern wird und gleichzeitig ein T-Score von -1,5 oder geringer an der LWS, oder dem Gesamtfemur oder dem Femurhals vorliegt, oder – wenn eine oder mehrere niedrigtraumatische Wirbelkörperfrakturen nach den oben definierten Kriterien vorliegen. Fortlaufend nach Beginn einer mittel- oder hochdosierten oralen Glucocorticoid-Therapie sollte eine Re-Evaluation erfolgen, wie lange und in welcher Dosis eine Fortführung der Glucocorticoidtherapie erforderlich ist. |
Empfehlungsgrad A |
| Evidenzgrad 1 Adachi et al. 2001 SIGN 1+ Reid et al. 2001 SIGN 1- |
|
| Konsensstärke 18/18 Starker Konsens |
|
Auch die Glucocorticoid-Therapie ≥7,5 mg Prednisolonäquivalent pro Tag gehört zu den Risikofaktoren, die mit einem hohen Frakturrisiko innerhalb der ersten 12 Monate verbunden ist. Es wird auf das entsprechende Kapitel zum Risikofaktor Glucocorticoid-Therapie verwiesen 4.7.1. Aus diesem Grunde soll rasch eine Therapie zur Frakturrisikosenkung im Einklang mit internationalen Empfehlungen erfolgen, wenn die Therapie >3 Monate durchgeführt werden muss.
Im Kapitel 9.5.2. sind die zur Osteoprotektion bei Glucocorticoid-Therapie empfohlenen Therapieoptionen festgehalten. In den Zulassungsstudien der Präparate sind auch prämenopausale Frauen und jüngere Männer eingeschlossen gewesen, Patientengruppen, die nicht primäre Adressaten der Leitlinie sind. In diesem Zusammenhang wird deswegen nochmals ausdrücklich auf die Empfehlungen der Deutschen Gesellschaft für Rheumatologie zur Glucocorticoid-induzierten Osteoporose verwiesen (Leipe J et al. 2021 📖Leipe J, Holle JU, Weseloh C, Pfeil A, Krüger K; die Kommission Pharmakotherapie der Deutschen Gesellschaft für Rheumatologie e. V. (DGRh). Empfehlungen der Deutschen Gesellschaft für Rheumatologie zum Management der Glucocorticoid-induzierten Osteoporose [German Society of Rheumatology Recommendations for the management of glucocorticoid-induced Osteoporosis. German version]. Z Rheumatol. 2021 Sep;80(7):670-687. German. doi: 10.1007/s00393-021-01028-w. Epub 2021 Aug 6. Erratum in: Z Rheumatol. 2022 Apr;81(3):263. PMID: 34357436.).
Zur Risikobewertung von oralen Glucocorticoiden in einer Dosis von <5 mg siehe Kapitel medikamentöse Therapie.
Ein endogenes Cushing-Syndrom ist, solange die endogene Kortisolüberproduktion besteht, in Bezug auf das Frakturrisiko und die therapeutischen Konsequenzen ähnlich wie eine hochdosierte orale Glucocorticoid-Therapie zu werten.
Es wird darauf verwiesen, dass unter einer hochdosierten Glucocorticoid-Therapie ab voraussichtlich mindestens 3 Monaten Dauer eine Substitution von Calcium und Vitamin D indiziert und Kassenleistung ist (Verweis auf Arzneimittelrichtlinien- www.g-ba.de/richtlinien/3/).
Die zur Abschätzung des absoluten Frakturrisikos verfügbaren neuen Risikomodelle sind in der Vergangenheit ausführlich bezüglich der jeweiligen Stärken und Schwächen der Modelle diskutiert worden. Dass Wirbelkörperfrakturen und Hüftfrakturen als relevante Frakturendpunkte das Krankheitsbild der Osteoporose und den Nutzen einer Osteoporose-Therapie besser abbilden als “Major Osteoporotic Fractures” (Summe aus Oberarmfrakturen, Radiusfrakturen, Hüftfrakturen und klinischen Wirbelkörperfrakturen), wurde auch durch veröffentlichte Literatur zu anderen Risikomodellen weiter bestätigt (s. Kapitel 7.6.).
Die Einbeziehung der Mortalität in den FRAX-Modellierungen über einen 10-Jahreszeitraum, die bei den älteren Patientinnen und Patienten zu einer Unterschätzung der Frakturinzidenz für einen kürzeren Lebenszeitraum führt und zur Folge haben kann, dass ein behandlungsbedürftiges Frakturrisiko unbehandelt bleibt, ist nicht zu favorisieren.
Da die meisten Zulassungsstudien zu Osteoporose-Medikamenten hinsichtlich des primären Studienergebnisses einen Zeitraum von 3 Jahren abdecken, zudem aus klinischer Sicht dieser Zeitraum im Sinne des „shared decision making“ den Patientinnen und Patienten gut vermittelt werden kann und insbesondere bei der Gruppe der hochbetagten Menschen mit dem höchsten aktuellen Frakturrisiko die besonders relevante Zeitspanne abbildet und neue Berechnungen im Rahmen der Risikorechnerarbeit eine Änderung des Frakturrisikovorhersagezeitraumes ermöglichten, wird mit dieser Leitlinienaktualisierung das 3-Jahres-Frakturrisiko bestimmt, an dem sich generelle Empfehlungen zur Diagnostik- und Therapieschwelle ausrichten. Dieses 3-Jahres-Frakturrisiko ist vergleichbar zu der bisher geltenden Leitlinie und den 10-Jahres-Berechnungen: Die Therapieschwellenüberschreitung ohne weitere Risikofaktoren bei Frauen ist im Alter von 77 Jahren (zuvor 75 Jahre) gegeben.
Bei der Berechnung des 3-Jahres-Risikos ist eine Berücksichtigung der Mortalität nicht erforderlich, da diese über diesen kürzeren Zeitraum gering ist, mit vernachlässigbarem Effekt.
Die vorhandenen Risikofaktoren sollten möglichst mit Interaktionen untereinander berücksichtigt werden, weswegen aus festgelegten Risikofaktorgruppen immer nur ein Risikofaktor, der stärkste, berücksichtigt werden soll, dies bei insgesamt zwei möglichen Risikofaktoren aus zwei Gruppen.
Das Modell ist in der Intention primär auf das medikamentös behandelbare Frakturrisiko ausgerichtet. Nicht für alle Risikofaktoren ist belegt, dass die Behandlungseffizienz des erhöhten Risikos durch eine medikamentöse Therapie auch tatsächlich der durchschnittlichen Behandlungseffizienz unter Ausschluss verschiedener Risikofaktoren bei der Zulassungsstudie eines therapeutischen Ansatzes entspricht.
Als Indikationsschwellenwert für eine medikamentöse Therapie wurde auf der Grundlage der Annahmen des neuen DVO-Risikomodells und des Risikorechners ein geschätztes (behandelbares) 3-Jahres-Frakturrisiko von durchschnittlich 5 % und mehr für Schenkelhalsfrakturen und vertebrale Frakturen definiert. Dies ist im Vergleich zu anderen verwendeten Risikoschwellen (z. B. bei FRAX) eine konservative Einschätzung der Fallzahlen zu therapierender Patientinnen und Patienten. Aus diesem Grund wird bei Vorliegen starker und/oder irreversibler bzw. sehr hoher imminenter Risikofaktoren empfohlen, eine medikamentöse Therapie auch in Erwägung zu ziehen, wenn das Frakturrisiko zwischen 3 % und 5 %/3 Jahre liegt, um eine Frakturrisikosenkung rechtzeitig zu erlangen. Hinsichtlich der in diesem Falle zu priorisierenden Medikamente wird auf das Kapitel 9 „Medikamentöse Therapie“ verwiesen.
| Empfehlung | |
|
Bei gegebener Indikation für eine medikamentöse Therapie soll den Patientinnen und Patienten eine medikamentöse Therapie mit gesicherter Frakturrisikoreduktion empfohlen werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 wegen Daten aus Zulassungsstudien |
|
| Konsensstärke 19/19 Starker Konsens |
|
| Empfehlung | |
|
Eine spezifische medikamentöse Therapie soll ab einem 3- Jahres-Frakturrisiko von 5 % für Schenkelhalsfrakturen und Wirbelkörperfrakturen empfohlen werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 wegen Daten aus Zulassungsstudien |
|
| Konsensstärke 18/18 Starker Konsens |
|
| Empfehlung | |
|
Eine spezifische medikamentöse Therapie sollte ab einem 3- Jahres-Frakturrisiko zwischen 3 % und 5 % für Schenkelhalsfrakturen und Wirbelkörperfrakturen in Betracht gezogen werden, wenn starke oder irreversible Risikofaktoren oder ein sehr hohes Risiko einer unmittelbar bevorstehenden Fraktur („imminent fracture risk“) vorliegen.
|
Empfehlungsgrad B |
| Evidenzgrad Expertenkonsens |
|
| Konsensstärke 19/19 Starker Konsens |
|
| Empfehlung | |
|
Eine spezifische medikamentöse Therapie mit osteoanabol wirksamen Substanzen (Romosozumab oder Teriparatid) soll ab einem 3-Jahres-Frakturrisiko von 10 % für Schenkelhalsfrakturen und Wirbelkörperfrakturen empfohlen werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 wegen Daten aus Head to Head Studien Saag und Kendler wie in Kapitel Therapie |
|
| Konsensstärke Im Kapitel medikamentöse Therapie bereits konsentiert 17/18 Konsens |
|
Sondervotum der DEGAM: Eine spezifische medikamentöse Therapie mit osteoanabol wirksamen Substanzen (Romosozumab oder Teriparatid) sollte ab einem 3-Jahres-Frakturrisiko von 10 % für Schenkelhalsfrakturen und Wirbelkörperfrakturen empfohlen werden. Empfehlungsgrad B
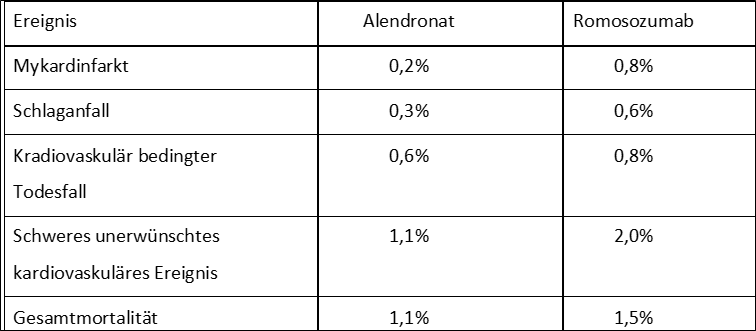
Begründung der DEGAM: in der relevanten Zulassungsstudie für Romosozumab (ARCH, N Engl J Med 2017; 377:1417-1427 DOI: 10.1056/NEJMoa1708322) betrug das durchschnittliche Risiko für Wirbelkörper- und Hüftfrakturen – wenn man den Therapieeffekt in der Alendronat-Gruppe mitberücksichtigt – 20 %, bezogen auf die Studiendauer von 2 Jahren. Demgegenüber liegt die NNH für unerwünschte Gefäßereignisse wie Schlaganfälle und Herzinfarkte (MACE) bei 111, entsprechend einer Hazard Ratio von 1,87 (95 %-Konfidenzintervall [1,11bis 3,14]) und es zeigte sich eine Tendenz zu erhöhter Mortalität.
Das IQWIG bescheinigte der Substanz aus diesem Grund auch nur einen geringen Zusatznutzen:(https://www.iqwig.de/de/projekteergebnisse/projekte/arzneimittelbewertung/2020/a20-67-romosozumab-osteoporose-addendum-zum-auftrag-a20-24.13266.html ).
Aus der Abwägung zwischen Nutzen und Risiken kann daher ab einem 10%igen 3-Jahres-Risiko für die beschriebenen Frakturen nur eine abgeschwächte Empfehlung abgegeben werden.
Für Teriparatid hat das IQWIG im Vergleich zu Antiresorptiva lediglich bezogen auf Wirbelkörperfrakturen eine Überlegenheit anerkannt bei erhöhtem Risiko für Übelkeit (https://www.iqwig.de/projekte/a19-10.html). Außerdem ist das prinzipielle Risiko für die Förderung von Knochentumoren zu berücksichtigen (https://www.ema.europa.eu/en/documents/product-information/forsteo-epar-product-information_de.pdf). Daher kann auch hier nur eine abgeschwächte Positiv-Empfehlung abgegeben werden. Die DEGAM empfiehlt, in geteilter Entscheidungsfindung die Vor- und Nachteile der unterschiedlichen Therapieoptionen, insbesondere bei Hochrisiko-Patientinnen und Patienten, mit den Betroffenen ergebnisoffen zu besprechen.
Die Frakturdaten aus der Arch-Studie sind in Kapitel 9.5. zutreffend beschrieben, allerdings wurden dort nicht die Daten zu unerwünschten Ereignissen beziffert. Sie beziehen sich auf die Gesamtgruppe und gelten gleichermaßen für Frauen mit und ohne bekannte kardiovaskuläre Vorerkrankungen und lauten jeweils Alendronat vs. Romosozumab:
| Empfehlung | |
|
Bei einem absoluten Frakturrisiko oberhalb von 5 % und unterhalb von 10 % kann der Einsatz einer osteoanabol wirksamen Substanz (Teriparatid oder Romosozumab) erwogen werden*.
* unter Beachtung des Zulassungsstatus und der Kontraindikationen |
Evidenzgrad 1 |
| Empfehlungsgrad 0 |
|
| Konsensstärke 19 von 19 Starker Konsens Konsentierte Schwelle aus Kapitel 9.5.3.1. |
|
| Belegende Evidenzen:
Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-1427. doi: 10.1056/NEJMoa1708322. Epub 2017 Sep 11. PMID: 28892457. LoE 2 Kendler DL, Marin F, Zerbini CAF, Russo LA, Greenspan SL, Zikan V, Bagur A, Malouf-Sierra J, Lakatos P, Fahrleitner-Pammer A, Lespessailles E, Minisola S, Body JJ, Geusens P, Möricke R, López-Romero P. Effects of teriparatide and risedronate on new fractures in post-menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018 Jan 20;391(10117):230-240. doi: 10.1016/S0140-6736(17)32137-2. Epub 2017 Nov 9. Erratum in: Lancet. 2017 Nov 30; Erratum in: Lancet. 2018 Dec 1;392(10162):2352. PMID: 29129436. LoE2 |
|
Über den Empfehlungskorridor ergibt sich die Möglichkeit, bei Risikopatientinnen und Risikopatienten mit starken Frakturrisikofaktoren früher mit der Frakturrisikosenkung durch Einleitung einer medikamentösen Therapie zu beginnen. Eine Evaluation der Empfehlungen ist im Rahmen der Leitlinienvalidierung vorgesehen. Die osteoanabol wirksamen Substanzen Teriparatid und Romosozumab können auch dann eingesetzt werden, wenn das Frakturrisiko für vertebrale Frakturen und Schenkelhalsfrakturen unterhalb von 10 % und oberhalb von 5 % liegt, da für beide Substanzen auch Studiendaten in einem Kollektiv mit geringerem Frakturrisiko vorliegen und die frakturrisikosenkende Potenz belegen (s. auch Kapitel 9 „Medikamentöse Therapie“).
Folgende Annahmen zu NNTs bleiben bestehen: Für antiresorptiv wirkende Therapeutika wird bei einer geschätzten therapeutischen Effizienz von 50 % für Wirbelfrakturen und 30 % für periphere Frakturen bei postmenopausalen Frauen und einem Risiko für klinische Wirbelköper- oder hüftnahe Frakturen von 5 % in 3 Jahren von einer durchschnittlichen “Number needed to treat (NNT)” für einen Behandlungszeitraum von 3 Jahren von 50 ausgegangen. Diese NNT verbessert sich mit der Höhe des Ausgangsfrakturrisikos sowie der Dauer der Therapie und nimmt dann Werte <50 an.
Bei diesen Zahlenangaben muss berücksichtigt werden, dass sie Schätzwerte darstellen. Sowohl das Basisrisiko ohne Risikofaktoren als auch die – vielfach unzureichend untersuchte – Interaktion verschiedener Risikofaktoren können zu abweichenden Risikowerten führen. Die Schätzungen des 3-Jahres-Frakturrisikos beruhen auf den Frakturdaten zu proximalen Femurfrakturen und Wirbelkörperfrakturen, die dem DVO-Frakturrisikomodell zugrunde gelegt sind. Zu beachten ist ferner, dass die Annahmen zur Therapieeffizienz beim Mann und die damit verbundenen Annahmen zu den NNTs unsicherer sind als bei der postmenopausalen Frau. Die Risikofaktortabelle dient zur Abschätzung der Indikationsschwelle zur Diagnose und Therapieeinleitung.
| Risiko/3 Jahre | 3 bis <5% | 5 bis <10% | ab 10% |
| Eine spezifische medikamentöse Therapie | sollte in Betracht gezogen werden, wenn starke oder irreversible Risikofaktoren oder ein sehr hohes Risiko einer unmittelbar bevorstehenden Fraktur („imminent fracture risk“) vorliegen. |
soll empfohlen werden (1) differenzialtherapeutischkann der Einsatz einer osteoanabol wirksamen Substanz (Teriparatid oder Romosozumab) unter Beachtung des Zulassungs-status und der Kontraindikationen erwogen werden (2) |
soll mit osteoanabol wirksamen Substanzen (Romosozumab oder Teriparatid) empfohlen werden (1) Sondervotum DEGAM: sollte empfohlen werden (2) |
| Empfehlungsgrad | B | (1) A (2) 0 | (1) A (2) B |
Die nachfolgende Tabelle zeigt die Konstellationen für einen gegebenen T-Score, bei denen die 3 %-, 5 %- oder 10 %-Therapieindikationsschwelle bei einem für 3 Jahre berechneten Frakturrisiko anzunehmen ist. Die Faktoren (Risikogradienten), die durch vorliegende Risikofaktoren erreicht werden müssen, sind in der Tabelle festgehalten. Farbig markiert ist der Bereich, in dem bereits bei Vorliegen eines gemessenen T-Scores alleine aufgrund des Alters und unter Berücksichtigung des Geschlechtes die Therapieschwelle erreicht ist.
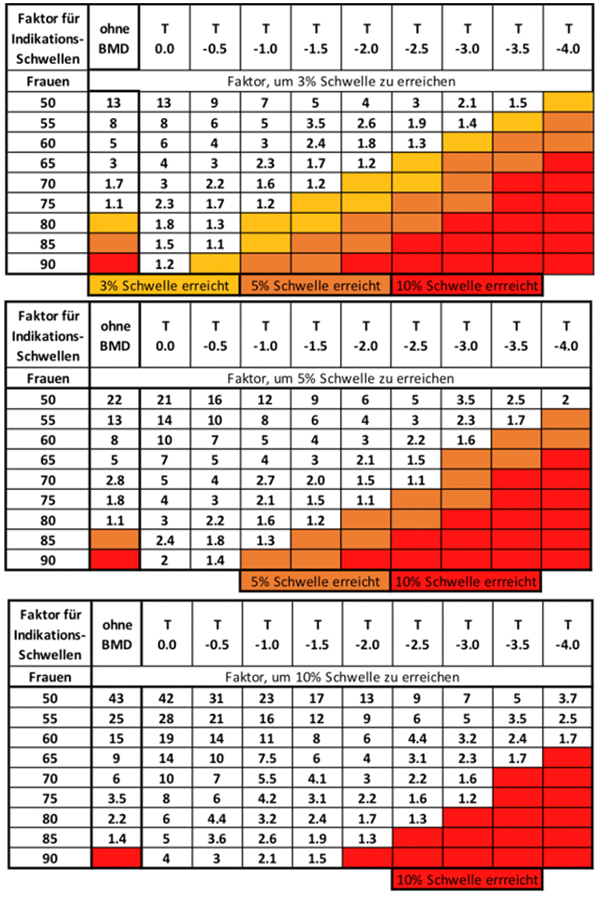
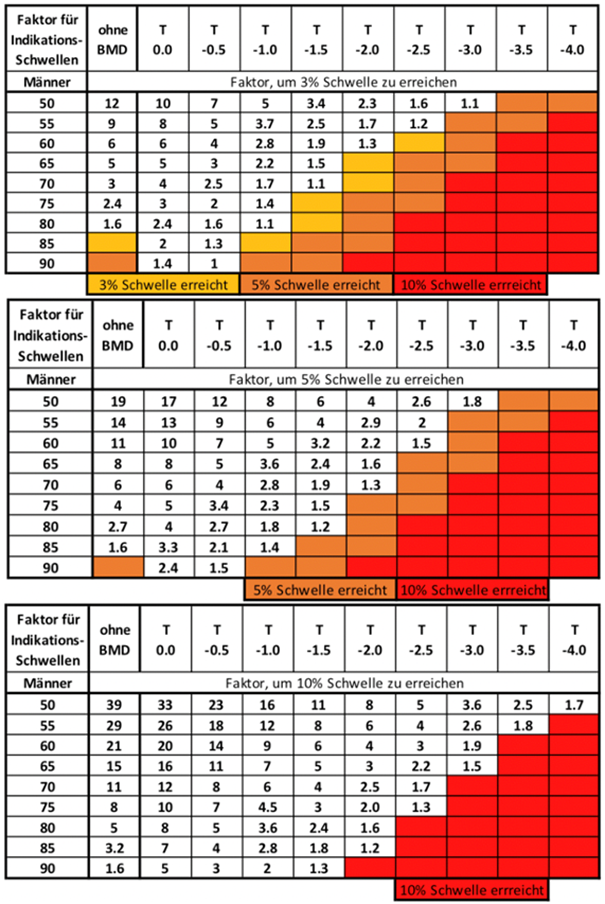
Entscheidungsgrundlage ist der Knochendichtewert am Gesamtfemur (Total Hip), bei Männern unter Verwendung eines männlichen Referenzkollektives für den T-Score. Bei einem stark von diesem Wert abweichendem Messwert an der LWS wird eine entsprechende Adjustierung nach Implementierung des Risikorechners erfolgen.
Die nachfolgende Tabelle gibt den Risikofaktorgradienten pro gegebenen Risikofaktor an, der bei einem gegeben T-Score und Alter bei Vorliegen des Risikofaktors erreicht wird. Diesen Risikogradienten gleicht man mit dem Faktor Knochendichtetabelle aus 9.4.6. ab, um zu sehen, ob die Therapieschwelle erreicht wird.
Ist dies nicht der Fall, so kann ein zweiter Risikofaktor berücksichtigt werden, der an den ersten Risikofaktor heranmultipliziert wird. Hierbei ist zu beachten, dass aus einer gegebenen Gruppe (gekennzeichnet durch WKx für Wirbelfrakturen, S für Sturz und G für Glucocorticoide) nur ein Risikofaktor berücksichtigt werden darf, der zweite Risikofaktor muss aus einer anderen Gruppe stammen. Insgesamt dürfen nur zwei Risikofaktoren miteinander multipliziert, also berücksichtigt werden, hierbei sollen die zwei stärksten Risikofaktoren beachtet werden.
Da die Tabelle komplex ist, wird der Mittelwert des Risikogradienten im Alter von 70 Jahren angegeben (Faktor Alter 70) anstelle der für eine gegebenen Altersgruppe (50, 60, 70, 80, 90), und gegebenen T-Score Total Hip (0, -2, -4) berechneten (Daten nicht in untenstehender Tabelle angegeben). Dies dient der Vereinfachung. Angegeben bleibt die Spanne des Risikofaktorgradienten über die Altersspanne von 50 bis 90, sodass die Varianz des Faktors mit dem Alter erkennbar bleibt.
| Gruppe | Risikofaktor | Faktor Alter 70 | Faktor Alter 50 -> 90 |
| Pro Gruppe nur den stärksten kRF einsetzen, 2. kRF muss aus anderer Gruppe kommen |
|||
| Wirbelfraktur(en) | |||
| WKFx | Wirbelfraktur(en) im letzten Jahr | 2,9 | 3,0 -> 2,5 |
| Wirbelfraktur(en) > 12 Monate Zeitabstand | |||
| WKFx | 1 osteoporotischer Wirbelbruch | 2 | 2 |
| WKFx | 2 osteoporotische Wirbelbrüche | 2,9 | 3,0 -> 2,5 |
| WKFx | 3 oder mehr osteoporotische Wirbelbrüche | 5 | 5,4 -> 3,8 |
| WKFx | Wirbelbruch Schweregrad max Grad 1 Genant | 2 | 2 |
| WKFx | Wirbelbruch Schweregrad max Grad 2 Genant | 2,9 | 3,0 -> 2,5 |
| WKFx | Wirbelbruch Schweregrad mac Grad 3 Genant | 5 | 5,3 -> 4,1 |
| Hüftfraktur und andere Frakturen | |||
| Hüftfraktur im letzten Jahr | 4,1 | 3,8 -> 5,1 | |
| Hüftfraktur > 12 Monate Zeitabstand | 2,5 | 2,4 -> 2,8 | |
| Humerusfraktur | 1,7 | 1,7 | |
| Handgelenksfraktur | 1,6 | 1,5 -> 1,7 | |
| Beckenfraktur | 1,7 | 1,5 -> 2,2 | |
| Allgemeine Risikofaktoren | |||
| Mutter oder Vater mit Hüftbruch | 1,3 | 1,2 -> 1,5 | |
| Erheblicher Alkoholkonsum (ab 50 g/Tag) | 1,9 | 1,9 -> 1,8 | |
| Rauchen (aktuell >10 Zigaretten/Tag) oder | 1,5 | 1,5 | |
| Chronische Obstruktive Lungenerkrankung Body Mass Index BMI ≤ 15 kg/m2 15 – 18,5 kg/m2 18,5 -< 20 kg/m2 |
1,3
2,2 |
1,3
2,0 -> 2,9 |
|
| Rheumatologie und Glukokortikoide | |||
| Axiale Spondyloarthritis | 1,6 | 1,7 -> 1,2 | |
| G | Rheumatoide Arthritis | 2,7 | 2,7 -> 2,5 |
| G | Prednisolonäquivalent bis 2,5 mg/Tag >3Monate | 1,4 | 1,4 -> 1,2 |
| G | Prednisolonäquivalent 2,5 – 7,5 mg/Tag >3 Monate | 2,3 | 2,3 -> 2,0 |
| G | Prednisolonäquivalent > 7,5 mg/Tag > 3 Monate | 4 | 4,3 -> 3,0 |
| G | Prednisolonäquivalent ab 7,5 mg/Tag, neu im letzten Jahr | 4,9 | 5,4 -> 3,4 |
| Sturzrisiko assoziierte Risikofaktoren/Geriatrie | |||
| S | >1 Sturz im letzten Jahr (1-Jahres Risiko RR) | 2 | 1,9 -> 2,1 |
| S | 1 Sturz im letzten Jahr | 1,6 | 1,6 |
| S | Chronische Hyponatriämie | 1,4 | 1,3 -> 1,7 |
| S | Depression/Antidepressiva | 1,3 | 1,3 |
| S | Epilepsie | 1,2 | 1,2 -> 1,4 |
| S | Immobilität (angewiesen sein auf eine Gehhilfe) | 1,7 | 1,7 -> 1,8 |
| S | M. Alzheimer/Demenz | 1,6 | 1,5 -> 2,1 |
| S | M.Parkinson | 1,7 | 1,5 -> 2,2 |
| S | Multiple Sklerose | 2,1 | 2,0 ->2,7 |
| S | Opioide | 1,4 | 1,3 -> 1,7 |
| S | Schlaganfall | 1,6 | 1,4 -> 2,0 |
| S | Timed up and Go Test > 12 Sek. | 1.8 | 1,6 -> 2,4 |
| Endokrinologie | |||
| Diabetes mellitus Typ I | 2,5 | 2,2 -> 2,3 | |
| Diabetes mellitus Typ II, seit 5-10 Jahren | 1,2 | 1,1 -> 1,3 | |
| Diabetes mellitus Typ II, seit > 10 Jahre | 1,6 | 1,4 -> 2,0 | |
| Primärer Hyperparathyreoidismus | 2,2 | 2,4 -> 1,5 | |
| TSH 0,1-0,45 | 1,2 | 1,2 -> 1,3 | |
| TSH <0,1 | 1,2 | 1,2 -> 1,4 | |
| Gruppe | Risikofaktor | Faktor Alter 70 | Faktor Alter 50 -> 90 |
| Pro Gruppe nur den stärksten kRF einsetzen, 2. kRF muss aus anderer Gruppe kommen |
|||
| Weitere Erkrankungen/Medikationen | |||
| Chronische Herzinsuffizienz | 1,5 | 1,5 | |
| MGUS | 2 | 2,1 -> 1,7 | |
| Niereninsuffizienz CKD 3a, 3b, 4 | 1,6 | 1,5 -> 1,8 | |
| Protonenpumpenhemmer > 3 Monate | 1,4 | 1,4 -> 1,3 | |
| TBS | |||
| TBS Z-Score: -1,0 SD | 1,3 | 1,3 | |
| TBS Z-Score: -1,5 SD | 1,4 | 1,4 | |
| TBS Z-Score: -2,0 SD | 1,6 | 1,6 | |
| TBS Z-Score: -2,5 SD | 1,8 | 1,8 | |
Behebbare Risiken sollten nur dann berücksichtigt werden, wenn das Risiko aktuell besteht oder vor weniger als 12-24 Monaten beendet worden ist.
Die Anzahl der im Risikorechner berücksichtigten Risikofaktoren ist auf die zwei stärksten begrenzt, da die Interaktionen der Risikofaktoren in vielen Fällen nicht ausreichend bekannt sind.
Die Verwendung von FRAX erlaubt Aussagen zur 10- Jahres-Frakturwahrscheinlichkeit, wenngleich in Bezug auf andere Frakturendpunkte und mit weiteren Unterschieden, wie sie in Kap. 7.6 ff. dargelegt sind. Sofern das Risikoprofil der Patientin/des Patienten mit den im FRAX eingestellten Risikofaktoren adäquat abgebildet werden kann, kann das FRAX-basierte Frakturrisiko alternativ vergleichend zurate gezogen werden. Hierbei würde ein 5%iges 3-Jahres-Risiko für Wirbelkörperfrakturen und proximalen Femurfrakturen nach DVO einem FRAX basierten Risiko von etwa 9%igem 10 Jahres-Risiko für Hüft- Frakturen entsprechen.
Des Weiteren bleibt die Möglichkeit in Einzelfällen, das alte DVO-Modell (das sog. Treppenschema zur Therapieindikation) weiterzuverwenden. Die alte DVO-Tabelle sollte nur in Ausnahmefällen, wenn z. B. eine Versorgungskontinuität nicht anderes gesichert werden kann, weiter genutzt werden.
Die Papiertabellen sollen generell entfallen, sobald der Risikorechner eingesetzt werden kann.
Gegenstand dieses Kapitels ist die spezifische medikamentöse Therapie der Osteoporose bei postmenopausalen Frauen und bei Männern. Die DVO-Leitlinie 2017 (AWMF-Register-Nr.: 183/001) beinhaltet ein systematisches Literaturreview bis Juni 2016, auf das in diesem Kapitel verwiesen wird und auf dem dieses Kapitel aufbaut. Für den Zeitraum ab 2016 bis 1. Juli 2018 wurde erneut ein systematischer Review durchgeführt (siehe Methodenreport), der nahtlos an den vorherigen im Zeitraum anschließt. Für die Literatur bis Juni 2016 verweisen wir auf den Leitlinientext 2017. Für den Zeitraum von Juli 2018 bis Dezember 2021 wurden durch die Kapitelautoren die Ergebnisse einer nicht-systematischen Literatursuche ergänzt. Der Text bezieht nur Präparate ein, die in Europa zugelassen sind und auf dem Markt in Deutschland, Österreich oder der Schweiz verfügbar sind (daher nicht Strontiumranelat). Bazedoxifen ist nur in der Schweiz verfügbar. Abaloparatid wurde erst nach Fertigstellung dieses Kapitels durch die EMA im Dezember 2022 zugelassen und ist zum Zeitpunkt der Fertigstellung der Leitlinie nicht verfügbar. Eine entsprechende Aktualisierung der Leitlinie ist geplant.
Ziel dieses Kapitels der Leitlinie ist es, die wissenschaftliche Evidenz zu den verfügbaren und zugelassenen Präparaten darzulegen und zu bewerten, sowie darauf basierend unter Abwägung von Nutzen und Schaden das derzeitige Vorgehen der Wahl zu empfehlen. Zusammen mit jeder Patientin und jedem Patienten ist die Therapieentscheidung vor diesem Hintergrund und unter Berücksichtigung der individuellen Situation zu treffen.
Zunächst werden – anhand des belegten fraktursenkenden Nutzens – die Präparate definiert, die bei Indikation zur spezifischen Osteoporose-Therapie (siehe Kapitel 9.4.) zum Einsatz kommen sollen (9.5.1). Nachfolgend wird auf Therapiesituationen hingewiesen, für die spezielle Zulassungen bestehen (9.5.2). Im Kapitel 9.5.3 sollen evidenzbasierte Entscheidungshilfen für die Auswahl des geeigneten Präparates in der individuellen Therapiesituation unter Berücksichtigung der Wirksamkeit und der Nebenwirkungen und der Konsequenzen für die Therapiesequenz gegeben werden. Kapitel 9.5.4 adressiert die Methoden zu Erfassung des Therapieansprechens.
Die in Bezug auf eine Frakturreduktion bei der postmenopausalen Frau am besten belegten medikamentösen Therapieoptionen sind Alendronat, Bazedoxifen, Denosumab, Ibandronat, Östrogene, Raloxifen, Risedronat, Romosozumab (Cosman F et al. 2016 📖Cosman F, Crittenden DB, Adachi JD, Binkley N, Czerwinski E, Ferrari S, Hofbauer LC, Lau E, Lewiecki EM, Miyauchi A, Zerbini CA, Milmont CE, Chen L, Maddox J, Meisner PD, Libanati C, Grauer A. Romosozumab Treatment in Postmenopausal Women with Osteoporosis. N Engl J Med. 2016 Oct 20;375(16):1532-1543. doi: 10.1056/NEJMoa1607948. Epub 2016 Sep 18. PMID: 27641143. LoE 2), Teriparatid (rhPTH 1-34) und Zoledronat. Die verfügbare Evidenz ist in der folgenden Tabelle zusammengefasst:
| Risikoreduktion für | Wirbelkörper- frakturen |
Periphere Frakturen | Proximale Femurfrakturen |
| Alendronat | A | A | A |
| Bazedoxifen | A | B | – |
| Denosumab | A | A | A |
| Ibandronat | A | B | – |
| Östrogene | A | A | A |
| Raloxifen | A | – | – |
| Risedronat | A | A | A |
| Romosozumab* | A | A | A |
| Teriparatid** | A | A | A |
| Zoledronat | A | A | A |
| *Belegende Evidenz:
Cosman F, Crittenden DB, Adachi JD, Binkley N, Czerwinski E, Ferrari S, Hofbauer LC, Lau E, Lewiecki EM, Miyauchi A, Zerbini CA, Milmont CE, Chen L, Maddox J, Meisner PD, Libanati C, Grauer A. Romosozumab Treatment in Postmenopausal Women with Osteoporosis. N Engl J Med. 2016 Oct 20;375(16):1532-1543. doi: 10.1056/NEJMoa1607948. Epub 2016 Sep 18. PMID: 27641143. LoE 2 Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-1427. doi: 10.1056/NEJMoa1708322. Epub 2017 Sep 11. PMID: 28892457. LoE 2 **Belegende Evidenz: Simpson EL, Martyn-St James M, Hamilton J, Wong R, Gittoes N, Selby P, Davis S. Clinical effectiveness of denosumab, raloxifene, romosozumab, and teriparatide for the prevention of osteoporotic fragility fractures: A systematic review and network meta-analysis. Bone. 2020 Jan;130:115081. doi: 10.1016/j.bone.2019.115081. Epub 2019 Oct 15. PMID: 31626995. LoE 1 Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, Hodsman AB, Eriksen EF, Ish-Shalom S, Genant HK, Wang O, Mitlak BH. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001 May 10;344(19):1434-41. doi: 10.1056/NEJM200105103441904. PMID: 11346808. 1+SIGN |
|||
A: starke Empfehlung aufgrund vorliegender Evidenz, B: Empfehlung aufgrund vorliegender Evidenz
Weitere Informationen zu den hier genannten Präparaten finden sich in den folgenden Abschnitten, wobei insbesondere auf Kapitel 9.5.3 mit allgemeinen Hinweisen sowie Nennung von Zusatz- und unerwünschten Wirkungen in Abschnitt 9.5.3.4. hingewiesen sei.
Änderungen im Vergleich zur vorangehenden Leitlinienversion:
Neu aufgenommen wurde der in der Zwischenzeit für die Behandlung der manifesten Osteoporose bei postmenopausalen Frauen mit deutlich erhöhtem Frakturrisiko zugelassene monoklonale Sklerostin-Antikörper Romosozumab. In der randomisierten, kontrollierten ARCH-Studie (Saag KG et al. 2017 📖Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-1427. doi: 10.1056/NEJMoa1708322. Epub 2017 Sep 11. PMID: 28892457. LoE 2) traten unter Romosozumab im Vergleich zu Alendronat signifikant weniger neue vertebrale Frakturen, neue klinische Frakturen, Hüftfrakturen und nicht-vertebrale Frakturen auf.
Zudem wurde die verfügbare Evidenz für Teriparatid neu bewertet. Für Teriparatid konnte bereits in der ersten großen randomisierten, placebokontrollierten Studie aus 2001 (Neer RM et al. 2001 📖Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, Hodsman AB, Eriksen EF, Ish-Shalom S, Genant HK, Wang O, Mitlak BH. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001 May 10;344(19):1434-41. doi: 10.1056/NEJM200105103441904. PMID: 11346808.) eine signifikante Zunahme der Knochendichte an der Hüfte und eine signifikante Reduktion nicht-vertebraler Frakturen gezeigt werden. In der Placebogruppe traten vier Fragilitätsfrakturen der Hüfte auf, in der 20µg/Tag-Teriparatid-Gruppe eine. Vergleichbare Ergebnisse lieferte eine japanische Studie (Miyauchi A et al. 2010 📖Miyauchi A, Matsumoto T, Sugimoto T, Tsujimoto M, Warner MR, Nakamura T. Effects of teriparatide on bone mineral density and bone turnover markers in Japanese subjects with osteoporosis at high risk of fracture in a 24-month clinical study: 12-month, randomized, placebo-controlled, double-blind and 12-month open-label phases. Bone. 2010 Sep;47(3):493-502. doi: 10.1016/j.bone.2010.05.022. Epub 2010 May 24. PMID: 20580870.) für Knochendichte der Hüfte und nicht-vertebrale Frakturen. In der Abaloparatid-Zulassungsstudie wurde der primäre Endpunkt (vertebrale Frakturen im Vergleich zur Placebogruppe) sowohl von Abaloparatid als auch von Teriparatid erreicht, jedoch der sekundäre Endpunkt „nicht-vertebrale Frakturen“ war nur für Abalaparatid signifikant (Miller PD et al. 2016 📖Miller PD, Hattersley G, Riis BJ, Williams GC, Lau E, Russo LA, Alexandersen P, Zerbini CA, Hu MY, Harris AG, Fitzpatrick LA, Cosman F, Christiansen C; ACTIVE Study Investigators. Effect of Abaloparatide vs Placebo on New Vertebral Fractures in Postmenopausal Women With Osteoporosis: A Randomized Clinical Trial. JAMA. 2016 Aug 16;316(7):722-33. doi: 10.1001/jama.2016.11136. Erratum in: JAMA. 2017 Jan 24;317(4):442. PMID: 27533157.). Teriparatid war in dieser Studie jedoch nicht verblindet. In der Teriparatidgruppe traten keine Hüftfrakturen auf, in der Placebogruppe 0,2 %. Neuere Metaanalysen belegen die Wirksamkeit von Teriparatid bezüglich des Hüftfrakturrisikos (Davis S et al. 2020 📖Davis S, Simpson E, Hamilton J, James MM, Rawdin A, Wong R, Goka E, Gittoes N, Selby P. Denosumab, raloxifene, romosozumab and teriparatide to prevent osteoporotic fragility fractures: a systematic review and economic evaluation. Health Technol Assess. 2020 Jun;24(29):1-314. doi: 10.3310/hta24290. PMID: 32588816; PMCID: PMC7357239., Simpson EL et al. 2020 📖Simpson EL, Martyn-St James M, Hamilton J, Wong R, Gittoes N, Selby P, Davis S. Clinical effectiveness of denosumab, raloxifene, romosozumab, and teriparatide for the prevention of osteoporotic fragility fractures: A systematic review and network meta-analysis. Bone. 2020 Jan;130:115081. doi: 10.1016/j.bone.2019.115081. Epub 2019 Oct 15. PMID: 31626995.). Problematisch bei dieser Metaanalyse ist, dass Ergebnisse von Teriparatid und Abaloparatid teilweise subsumiert werden. Die Analyse zeigt eine Hazard Ratio für Hüftfrakturen von 0,35 unter Teriparatid versus Placebo (Davis S et al. 2020 📖Davis S, Simpson E, Hamilton J, James MM, Rawdin A, Wong R, Goka E, Gittoes N, Selby P. Denosumab, raloxifene, romosozumab and teriparatide to prevent osteoporotic fragility fractures: a systematic review and economic evaluation. Health Technol Assess. 2020 Jun;24(29):1-314. doi: 10.3310/hta24290. PMID: 32588816; PMCID: PMC7357239.).
Die in früheren Leitlinienversionen diskutierte Knochendichte-Schwelle für die Effektivität medikamentöser Therapien wird mangels verfügbarer Evidenz für die Existenz einer solchen Schwelle fallen gelassen. In den sehr alten Therapiestudien wurde als Einschlusskriterium die WHO-Definition von Osteoporose (nämlich T-Score <-2,5) verwendet. Daher bestand früher Unsicherheit bzgl. der Wirksamkeit bei T-Score >-2,5. Bereits in der letzten Leitlinienversion wurde darauf hingewiesen, dass in neueren Therapiestudien auch für orale Bisphosphonate eine Wirksamkeit bei T-Scores zwischen -2,0 und -2,5 belegt werden konnte. Zudem lagen bereits 2017 Studien vor, die eine Wirksamkeit von oralen Bisphosphonaten und SERM auch bei T-Scores oberhalb -2,0 nachwiesen. Mittlerweile hat sich diese Evidenz weiter erhärtet. So konnte für Denosumab eine gleich starke Frakturrisikoreduktion bei T-Scores oberhalb -1,0 als unterhalb -1,0 gezeigt werden (Gnant M et al. 2015 📖Gnant M, Pfeiler G, Dubsky PC, Hubalek M, Greil R, Jakesz R, Wette V, Balic M, Haslbauer F, Melbinger E, Bjelic-Radisic V, Artner-Matuschek S, Fitzal F, Marth C, Sevelda P, Mlineritsch B, Steger GG, Manfreda D, Exner R, Egle D, Bergh J, Kainberger F, Talbot S, Warner D, Fesl C, Singer CF; Austrian Breast and Colorectal Cancer Study Group. Adjuvant denosumab in breast cancer (ABCSG-18): a multicentre, randomised, double-blind, placebo-controlled trial. Lancet. 2015 Aug 1;386(9992):433-43. doi: 10.1016/S0140-6736(15)60995-3. Epub 2015 May 31. PMID: 26040499.). Ähnliche Ergebnisse für Denosumab zeigten sich bei der Therapie von Männern unter antiandrogener Therapie (Smith MR et al. 2009 📖Smith MR, Egerdie B, Hernández Toriz N, Feldman R, Tammela TL, Saad F, Heracek J, Szwedowski M, Ke C, Kupic A, Leder BZ, Goessl C; Denosumab HALT Prostate Cancer Study Group. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009 Aug 20;361(8):745-55. doi: 10.1056/NEJMoa0809003. Epub 2009 Aug 11. PMID: 19671656; PMCID: PMC3038121. LoE 1+SIGN). Für Zoledronat liegt eine Therapiestudie bei über 65-jährigen postmenopausalen Frauen mit Osteopenie vor, die eine hochsignifikante fraktursenkende Wirksamkeit zeigte (Reid IR et al. 2019 📖Reid IR, Horne AM, Mihov B, Stewart A, Garratt E, Bastin S, Gamble GD. Effects of Zoledronate on Cancer, Cardiac Events, and Mortality in Osteopenic Older Women. J Bone Miner Res. 2020 Jan;35(1):20-27. doi: 10.1002/jbmr.3860. Epub 2019 Oct 11. PMID: 31603996.). In der Studie war die number needed to treat (NNT) unabhängig von der Knochendichte bei Studieneinschluss. Zusammenfassend liegt mittlerweile klare Evidenz dafür vor, dass die Wirksamkeit der spezifischen medikamentösen Therapien nicht abhängig von einer speziellen Schwelle der Knochendichte ist. Daher wird bei Vorliegen einer Osteoporose mit absolutem Frakturrisiko oberhalb der DVO-Therapieschwelle eine spezifische medikamentöse Therapie unabhängig vom T-Score der Knochendichte empfohlen.
Obige Tabelle stellt die Evidenzbewertung signifikanter Risikoreduktion in Bezug auf die inzidenten Frakturen verschiedener Lokalisationen dar. Die prävalente Fraktur stellt einen Risikofaktor für imminente Frakturen aller Lokalisationen dar, auch wenn das Risiko für eine Folgefraktur am selben Frakturort (Hüfte versus Wirbelsäule) am höchsten ist (Gehlbach S et al. 2012 📖Gehlbach S, Saag KG, Adachi JD, Hooven FH, Flahive J, Boonen S, Chapurlat RD, Compston JE, Cooper C, Díez-Perez A, Greenspan SL, LaCroix AZ, Netelenbos JC, Pfeilschifter J, Rossini M, Roux C, Sambrook PN, Silverman S, Siris ES, Watts NB, Lindsay R. Previous fractures at multiple sites increase the risk for subsequent fractures: the Global Longitudinal Study of Osteoporosis in Women. J Bone Miner Res. 2012 Mar;27(3):645-53. doi: 10.1002/jbmr.1476. PMID: 22113888; PMCID: PMC4881741., Hadji P et al. 2021 📖Hadji P, Schweikert B, Kloppmann E, Gille P, Joeres L, Toth E, Möckel L, Glüer CC. Osteoporotic fractures and subsequent fractures: imminent fracture risk from an analysis of German real-world claims data. Arch Gynecol Obstet. 2021 Sep;304(3):703-712. doi: 10.1007/s00404-021-06123-6. Epub 2021 Jul 11. PMID: 34247254; PMCID: PMC8325652.). Nur im individuellen Einzelfall kann ein erhöhtes Risiko für die eine oder andere Fraktur abgeschätzt werden (Bsp. Risiko für vertebrale Anschlussfraktur nach Vertebroplastie oder Risiko für proximale Femurfraktur bei rezidivierenden Stürzen).
| Empfehlung | |
|
Systemische Östrogene/Gestagene sollen nur bei Unverträglichkeit oder Kontraindikationen gegenüber den anderen Osteoporose-Therapeutika zur Therapie der Osteoporose eingesetzt werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz:
Gartlehner G, Patel SV, Feltner C, Weber RP, Long R, Mullican K, Boland E, Lux L, Viswanathan M. Hormone Therapy for the Primary Prevention of Chronic Conditions in Postmenopausal Women: Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 2017 Dec 12;318(22):2234-2249. doi: 10.1001/jama.2017.16952. PMID: 29234813. LoE 1 und Gartlehner G, Patel SV, Reddy S, Rains C, Schwimmer M, Kahwati L. Hormone Therapy for the Primary Prevention of Chronic Conditions in Postmenopausal Persons: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 2022 Nov 1;328(17):1747-1765. doi: 10.1001/jama.2022.18324. Erratum in: JAMA. 2023 Mar 21;329(11):943. PMID: 36318128. |
|
Östrogene sind zur Prävention einer Osteoporose bei postmenopausalen Frauen mit hohem Frakturrisiko zugelassen, die eine Unverträglichkeit oder Kontraindikation gegenüber anderen zur Osteoporose-Prävention zugelassenen Arzneimitteln aufweisen. Ein systematischer Review untersuchte 18 Studien zu Vor- und Nachteilen der Hormonersatztherapie (Gartlehner G et al. 2017 📖Gartlehner G, Patel SV, Feltner C, Weber RP, Long R, Mullican K, Boland E, Lux L, Viswanathan M. Hormone Therapy for the Primary Prevention of Chronic Conditions in Postmenopausal Women: Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 2017 Dec 12;318(22):2234-2249. doi: 10.1001/jama.2017.16952. PMID: 29234813.). Hier bestätigten sich unter Verwendung von konjugierten equinen Östrogenen (CEE) die Erkenntnisse zur Senkung der Frakturinzidenz, aber auch das erhöhte Risiko für andere Erkrankungen (Bsp. Thrombose, Schlaganfall, Gallensteine, Inkontinenz). Eine Östradiol-basierte Hormonersatztherapie in Standard-Dosierung (Östrogene und bei vorhandener Gebärmutter in Kombination mit Gestagenen), die aus anderer Indikation (Bsp. vasomotorische Symptome) begonnen wurde, kann als frakturrisikosenkende Osteoporose-Therapie angesehen werden. In der Regel ist dann keine weitere spezifische Osteoporose-Therapie erforderlich. Hinsichtlich Details zu Nutzen und Risiken einer Hormonersatztherapie wird auf die S3 Leitlinie Peri- und Postmenopause-Diagnostik und Interventionen unter Federführung der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (AWMF Registernummer 016-062) verwiesen. Wird aufgrund postmenopausaler Beschwerden Tibolon eingenommen, so ist auch hier ein Schutz vor Frakturen nachgewiesen (Cummings SR et al. 2008 📖Cummings SR, Ettinger B, Delmas PD, Kenemans P, Stathopoulos V, Verweij P, Mol-Arts M, Kloosterboer L, Mosca L, Christiansen C, Bilezikian J, Kerzberg EM, Johnson S, Zanchetta J, Grobbee DE, Seifert W, Eastell R; LIFT Trial Investigators. The effects of tibolone in older postmenopausal women. N Engl J Med. 2008 Aug 14;359(7):697-708. doi: 10.1056/NEJMoa0800743. PMID: 18703472; PMCID: PMC3684062.).
Für den Mann sind Alendronat (10 mg tgl.), Risedronat (35 mg wöchentlich), Zoledronat, Denosumab und Teriparatid zur Therapie der Osteoporose zugelassen. Diese Therapien sind weniger ausführlich als bei Frauen mit postmenopausaler Osteoporose in Form von Äquivalenzstudien zu den Surrogatparametern Knochendichte und Knochenumbauparameter untersucht worden. In einigen Studien wurde zusätzlich eine Reduktion vertebraler Frakturen gezeigt. In Ermangelung an Daten zur Frakturreduktion bei Männern erscheint es angemessen, die gleichen Strategien in der Therapie einzusetzen wie bei postmenopausalen Frauen.
Bei sekundären Osteoporoseformen wird auf besondere fachspezifische Aspekte bei der Auswahl der Osteoporose-Medikation verwiesen, die in dieser Leitlinie nicht umfänglich berücksichtigt sind. Hier wird ausdrücklich auf die Empfehlungen der jeweiligen Fachgesellschaften verwiesen.
Bei Risikofaktoren, die eine sekundäre Osteoporoseform mitbegründen, sollte eine fachspezifische Mitbetreuung im Rahmen der diesen Risikofaktoren zugrunde liegenden Erkrankung gewährleistet sein. Dies begründet sich über viele Besonderheiten, die mit der Therapie der jeweiligen Grunderkrankungen sowohl in Bezug auf spezielle Aspekte des Knochenstoffwechsels als auch in Bezug auf die Grunderkrankung selbst gegeben sind.
Im Besonderen sei hier auf den Hypogonadismus beim Mann verwiesen. Bei Vorliegen eines Hypogonadismus konnte durch Testosteronsubstitution in mehreren Studien eine Verbesserung der Knochendichte gezeigt werden (Katznelson L et al. 1996 📖Katznelson L, Finkelstein JS, Schoenfeld DA, Rosenthal DI, Anderson EJ, Klibanski A. Increase in bone density and lean body mass during testosterone administration in men with acquired hypogonadism. J Clin Endocrinol Metab. 1996 Dec;81(12):4358-65. doi: 10.1210/jcem.81.12.8954042. PMID: 8954042., Behre HM et al. 1997 📖Behre HM, Kliesch S, Leifke E, Link TM, Nieschlag E. Long-term effect of testosterone therapy on bone mineral density in hypogonadal men. J Clin Endocrinol Metab. 1997 Aug;82(8):2386-90. doi: 10.1210/jcem.82.8.4163. PMID: 9253305., Finkelstein 1989 📖Finkelstein JS, Klibanski A, Neer RM, Doppelt SH, Rosenthal DI, Segre GV, Crowley WF Jr. Increases in bone density during treatment of men with idiopathic hypogonadotropic hypogonadism. J Clin Endocrinol Metab. 1989 Oct;69(4):776-83. doi: 10.1210/jcem-69-4-776. PMID: 2674186., Wang C et al. 2004 📖Wang C, Cunningham G, Dobs A, Iranmanesh A, Matsumoto AM, Snyder PJ, Weber T, Berman N, Hull L, Swerdloff RS. Long-term testosterone gel (AndroGel) treatment maintains beneficial effects on sexual function and mood, lean and fat mass, and bone mineral density in hypogonadal men. J Clin Endocrinol Metab. 2004 May;89(5):2085-98. doi: 10.1210/jc.2003-032006. PMID: 15126525., Snyder PJ et al. 2017 📖Snyder PJ, Kopperdahl DL, Stephens-Shields AJ, Ellenberg SS, Cauley JA, Ensrud KE, Lewis CE, Barrett-Connor E, Schwartz AV, Lee DC, Bhasin S, Cunningham GR, Gill TM, Matsumoto AM, Swerdloff RS, Basaria S, Diem SJ, Wang C, Hou X, Cifelli D, Dougar D, Zeldow B, Bauer DC, Keaveny TM. Effect of Testosterone Treatment on Volumetric Bone Density and Strength in Older Men With Low Testosterone: A Controlled Clinical Trial. JAMA Intern Med. 2017 Apr 1;177(4):471-479. doi: 10.1001/jamainternmed.2016.9539. Erratum in: JAMA Intern Med. 2017 Apr 1;177(4):600. Erratum in: JAMA Intern Med. 2019 Mar 1;179(3):457. PMID: 28241231; PMCID: PMC5433755.). Kontrollierte Studien mit Frakturendpunktdaten liegen nicht vor, sodass nicht beurteilt werden kann, ob die alleinige Testosteronsubstitution bei Männern mit Hypogonadismus und Osteoporose eine ausreichende Osteoporose-Therapie darstellt.
Diabetes mellitus Typ 1 und 2 sind ein gewichtiger Risikofaktor für Frakturen. Soweit Daten vorhanden sind (Alendronat, Raloxifen, Teriparatid), führen die spezifischen Therapien zur gleichen Frakturrisikoreduktion wie bei Patientinnen und Patienten ohne Diabetes mellitus (Anagnostis P et al. 2017 📖Anagnostis P, Paschou SA, Mintziori G, Ceausu I, Depypere H, Lambrinoudaki I, Mueck A, Pérez-López FR, Rees M, Senturk LM, Simoncini T, Stevenson JC, Stute P, Trémollieres FA, Goulis DG. Drug holidays from bisphosphonates and denosumab in postmenopausal osteoporosis: EMAS position statement. Maturitas. 2017 Jul;101:23-30. doi: 10.1016/j.maturitas.2017.04.008. Epub 2017 Apr 15. PMID: 28539165. LoE 3). Dies gilt vor allem für die Risikoreduktion vertebraler Frakturen, die Ergebnisse bezüglich non-vertebraler Frakturen sind teilweise uneinheitlich. Eine post-hoc Analyse der FREEDOM-Studie untersuchte die Subgruppe der Diabetikerinnen und Diabetiker unter Denosumabtherapie (Ferrari S et al. 2020 📖Ferrari S, Eastell R, Napoli N, Schwartz A, Hofbauer LC, Chines A, Wang A, Pannacciulli N, Cummings SR. Denosumab in postmenopausal women with osteoporosis and diabetes: Subgroup analysis of FREEDOM and FREEDOM extension. Bone. 2020 May;134:115268. doi: 10.1016/j.bone.2020.115268. Epub 2020 Feb 10. PMID: 32058020.). Es zeigten sich eine kontinuierliche Zunahme der Knochendichte und eine anhaltend niedrige Rate vertebraler Frakturen im Vergleich zu Placebo. Die Ergebnisse sind gut vergleichbar mit den Ergebnissen der FREEDOM-Gesamtpopulation. Die Inzidenz nicht-vertebraler Frakturen war im zweiten Jahr signifikant erhöht, reduzierte sich aber im Verlauf auf das Niveau der Placebogruppe. Eine signifikante Reduktion der Inzidenz vertebraler Frakturen – wie in der FREEDOM-Gesamtpopulation – konnte nicht gezeigt werden.
Für orale und intravenöse Bisphosphonate konnte in einer Metaanalyse gezeigt werden, dass der Verlust an Knochendichte bei Patientinnen und Patienten mit chronisch entzündlicher Darmerkrankung vermindert und das Risiko für neue Frakturen gemildert werden kann (Yao L et al. 2017 📖Yao L, Wang H, Dong W, Liu Z, Mao H. Efficacy and safety of bisphosphonates in management of low bone density in inflammatory bowel disease: A meta-analysis. Medicine (Baltimore). 2017 Jan;96(3):e5861. doi: 10.1097/MD.0000000000005861. PMID: 28099343; PMCID: PMC5279088. LoE 1).
| Empfehlung | |
|
Bei Auftreten einer osteoporotischen Wirbelkörper- oder proximalen Femurfraktur soll die Einleitung der spezifischen medikamentösen Therapie möglichst rasch und ohne Verzögerung erfolgen.
Für andere osteoporotische Frakturen bei Patientinnen und Patienten mit hohem Frakturrisiko gilt die Empfehlung entsprechend. |
Empfehlungsgrad A |
| Evidenzgrad 2 |
|
| Konsensstärke 17/17 starker Konsens |
|
| Belegende Evidenz:
Eriksen EF, Lyles KW, Colón-Emeric CS, Pieper CF, Magaziner JS, Adachi JD, Hyldstrup L, Recknor C, Nordsletten L, Lavecchia C, Hu H, Boonen S, Mesenbrink P. Antifracture efficacy and reduction of mortality in relation to timing of the first dose of zoledronic acid after hip fracture. J Bone Miner Res. 2009 Jul;24(7):1308-13. doi: 10.1359/jbmr.090209. PMID: 19257818; PMCID: PMC5770985. 1 + SIGN |
|
| Empfehlung | |
|
Im Anschluss an eine osteoporotische proximale Femurfraktur sollte Zoledronat idealerweise erst ab einem Zeitintervall von 2 Wochen nach der Operation der Femurfraktur verabreicht werden, wenn die strukturierte Versorgung für eine Therapie sichergestellt ist.
|
Empfehlungsgrad B |
| Evidenzgrad 2 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz:
Eriksen EF, Lyles KW, Colón-Emeric CS, Pieper CF, Magaziner JS, Adachi JD, Hyldstrup L, Recknor C, Nordsletten L, Lavecchia C, Hu H, Boonen S, Mesenbrink P. Antifracture efficacy and reduction of mortality in relation to timing of the first dose of zoledronic acid after hip fracture. J Bone Miner Res. 2009 Jul;24(7):1308-13. doi: 10.1359/jbmr.090209. PMID: 19257818; PMCID: PMC5770985. 1+SIGN |
|
Dass behandlungsbedürftige Frakturpatientinnen und -patienten nicht leitliniengerecht behandelt werden, ist weiterhin eines der großen Versorgungsprobleme bei manifester Osteoporose (McCloskey E et al. 2021 📖McCloskey E, Rathi J, Heijmans S, Blagden M, Cortet B, Czerwinski E, Hadji P, Payer J, Palmer K, Stad R, O’Kelly J, Papapoulos S. The osteoporosis treatment gap in patients at risk of fracture in European primary care: a multi-country cross-sectional observational study. Osteoporos Int. 2021 Feb;32(2):251-259. doi: 10.1007/s00198-020-05557-z. Epub 2020 Aug 23. PMID: 32829471; PMCID: PMC7838133., Hadji P et al. 2020 📖Hadji P, Hardtstock F, Wilke T, Joeres L, Toth E, Möckel L, Gille P. Estimated epidemiology of osteoporosis diagnoses and osteoporosis-related high fracture risk in Germany: a German claims data analysis. Arch Osteoporos. 2020 Aug 12;15(1):127. doi: 10.1007/s11657-020-00800-w. PMID: 32783079.). Dieses Problem kann und muss über mehrere Wege adressiert werden, z. B. durch Etablierung von Fracture Liaison Service Strukturen (Hesse E et al. 2019 📖Hesse E, Böcker W, Kammerlander C, Stumpf U, Weber I, Maus U. Etablierung von Frakturnetzwerken in Deutschland [Establishment of fracture liaison services in Germany]. Unfallchirurg. 2019 Oct;122(10):766-770. German. doi: 10.1007/s00113-019-00705-5. PMID: 31414147.). Nach eingetretener Fraktur ist das Risiko für eine weitere Fraktur, insbesondere im ersten Jahr, besonders hoch. Daher wäre es wünschenswert, wenn die Einleitung einer spezifischen medikamentösen Therapie bei eingetretener Fraktur bereits durch die erstbehandelnde Einheit (i. d. R. die Unfallchirurgie) eingeleitet werden könnte, um dann im ambulanten Sektor fortgeführt zu werden. Dem steht eine Empfehlung des Herstellers von Zoledronat entgegen, der in seiner Fachinformation bei Patientinnen und Patienten mit einer niedrig-traumatischen Hüftfraktur die Verabreichung der Infusion frühestens zwei Wochen nach der operativen Versorgung der Hüftfraktur empfiehlt (Fachinformation Aclasta, Stand März 2020). Diese Empfehlung beruht auf einer Studie mit 2.127 randomisierten Patientinnen und Patienten ≥50 Jahren, die innerhalb von 90 Tagen nach Operation einer Niedrig-Trauma-Fraktur mit Zoledronat versus Placebo behandelt wurden (Eriksen EF et al. 2009 📖Eriksen EF, Lyles KW, Colón-Emeric CS, Pieper CF, Magaziner JS, Adachi JD, Hyldstrup L, Recknor C, Nordsletten L, Lavecchia C, Hu H, Boonen S, Mesenbrink P. Antifracture efficacy and reduction of mortality in relation to timing of the first dose of zoledronic acid after hip fracture. J Bone Miner Res. 2009 Jul;24(7):1308-13. doi: 10.1359/jbmr.090209. PMID: 19257818; PMCID: PMC5770985. 1+ SIGN). Der primäre Endpunkt „neue klinische Fraktur“ wurde signifikant erreicht. Da sich in einem experimentellen Ratten-Modell mit 14C-Zoledronat, das ein und zwei Wochen nach Fraktur appliziert wurde, eine höhere Anreicherung im Kallus als im kontralateralen Bein im Vergleich zu Applikation zum Zeitpunkt der Fraktur gezeigt hatte (Amanat N et al. 2007 📖Amanat N, McDonald M, Godfrey C, Bilston L, Little D. Optimal timing of a single dose of zoledronic acid to increase strength in rat fracture repair. J Bone Miner Res. 2007 Jun;22(6):867-76. doi: 10.1359/jbmr.070318. PMID: 17371160.), wurde eine post-hoc Analyse der Daten durchgeführt, um zu untersuchen, ob der Zeitpunkt der Zoledronatapplikation Einfluss auf Knochendichteanstieg, Frakuturrisikoreduktion bzw. Verminderung der Mortalität hat. Dazu wurden sieben 2-Wochen-Intervalle gebildet. Es zeigte sich für alle Zeitintervalle eine gleich starke, nicht signifikant unterschiedliche Wirkung auf Knochendichte, Frakturrisiko und Mortalität mit Ausnahme der Gruppe “≤2 Wochen”. Die Gruppe machte nur 5 % der Gesamtpopulation aus und unterschied sich bezüglich der demographischen Basisdaten von der Gesamtkohorte und hatte sehr große Konfidenzintervalle. Die Autoren schließen daher, dass es anders als in den Tierversuchen wohl zu keinem quantitativ relevanten Abfangen von Zoledronat in der Frakturregion kommt. Es könne sein, dass es zu marginal reduzierter Effektivität bei Applikation ≤2 Wochen kommt, wobei jedoch der fehlende Trend über die anderen Zeitpunkte eher gegen einen solchen Mechanismus spricht. Aktuelle präklinische Arbeiten legen nahe, dass eine besonders frühe Applikation von Zoledronat zum Frakturzeitpunkt besonders günstig sein könnte bezüglich Verhinderung des Knochendichteverlustes und zur Vermeidung von Weichgewebskalzifikationen – ohne die Frakturheilung zu stören (Saito M et al. 2021 📖Saito M, Moore-Lotridge SN, Uppuganti S, Egawa S, Yoshii T, Robinette JP, Posey SL, Gibson BHY, Cole HA, Hawley GD, Guelcher SA, Tanner SB, McCarthy JR, Nyman JS, Schoenecker JG. Determining the pharmacologic window of bisphosphonates that mitigates severe injury-induced osteoporosis and muscle calcification, while preserving fracture repair. Osteoporos Int. 2022 Apr;33(4):807-820. doi: 10.1007/s00198-021-06208-7. Epub 2021 Oct 31. PMID: 34719727.). Evidenzbelegt ist, dass die Gabe von Zoledronat ab einem Intervall von 2 Wochen nach Operation effektiv ist. Eine evidenzbasierte Aussage zum Einsatz ≤ 2 Wochen nach Operation ist nicht möglich. Der mögliche Wirkverlust ist als eher gering einzuschätzen und muss mit der Versorgungsrealität abgewogen werden. Falls eine Gabe jenseits der ersten 2 Wochen durch etablierte Strukturen sichergestellt ist, wird eine solche Gabe empfohlen. Falls die Gabe aufgrund der lokalen Versorgungsrealität nicht sichergestellt ist, kann eine Gabe bereits ≤2 Wochen erfolgen.
Für alle unter 9.5.1.1 genannten Substanzen ist eine Reduktion der Frakturrate über 3-5 Jahre nachgewiesen. Für eine Östrogenmonotherapie gibt es eine randomisierte kontrollierte Studie über 7,4 Jahre, für SERMs (Raloxifen und Bazedoxifen) randomisierte klinische Studien mit einer Studiendauer von 8 bzw. 7 Jahren mit einer signifikanten Frakturratenreduktion. Für Alendronat als Vertreter der oralen Bisphosphonate ist eine Frakturratenreduktion für 5 Jahre belegt. In der Verlängerungsstudie konnte die Sicherheit für 10 Jahre gezeigt werden (Bone HG et al. 2004 📖Bone HG, Hosking D, Devogelaer JP, Tucci JR, Emkey RD, Tonino RP, Rodriguez-Portales JA, Downs RW, Gupta J, Santora AC, Liberman UA; Alendronate Phase III Osteoporosis Treatment Study Group. Ten years’ experience with alendronate for osteoporosis in postmenopausal women. N Engl J Med. 2004 Mar 18;350(12):1189-99. doi: 10.1056/NEJMoa030897. PMID: 15028823.). Patientinnen und Patienten mit anhaltend hohem Risiko profitieren von der verlängerten Therapie bis 10 Jahre (Black DM et al. 2006 📖Black DM, Schwartz AV, Ensrud KE, Cauley JA, Levis S, Quandt SA, Satterfield S, Wallace RB, Bauer DC, Palermo L, Wehren LE, Lombardi A, Santora AC, Cummings SR; FLEX Research Group. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial. JAMA. 2006 Dec 27;296(24):2927-38. doi: 10.1001/jama.296.24.2927. PMID: 17190893. LoE 1+ SIGN, Bone HG et al. 2004 📖Bone HG, Hosking D, Devogelaer JP, Tucci JR, Emkey RD, Tonino RP, Rodriguez-Portales JA, Downs RW, Gupta J, Santora AC, Liberman UA; Alendronate Phase III Osteoporosis Treatment Study Group. Ten years’ experience with alendronate for osteoporosis in postmenopausal women. N Engl J Med. 2004 Mar 18;350(12):1189-99. doi: 10.1056/NEJMoa030897. PMID: 15028823., Schwartz AV et al. 2010 📖Schwartz AV, Bauer DC, Cummings SR, Cauley JA, Ensrud KE, Palermo L, Wallace RB, Hochberg MC, Feldstein AC, Lombardi A, Black DM; FLEX Research Group. Efficacy of continued alendronate for fractures in women with and without prevalent vertebral fracture: the FLEX trial. J Bone Miner Res. 2010 May;25(5):976-82. doi: 10.1002/jbmr.11. PMID: 20200926. LoE 1+ SIGN) im Vergleich zum Therapieabbruch. Für Zoledronat ist eine Frakturratenreduktion über 3 Jahre belegt. Patientinnen und Patienten mit anhaltend hohem Risiko profitieren von der verlängerten Therapie bis 6 Jahre (Black DM et al. 2012 📖Black DM, Reid IR, Boonen S, Bucci-Rechtweg C, Cauley JA, Cosman F, Cummings SR, Hue TF, Lippuner K, Lakatos P, Leung PC, Man Z, Martinez RL, Tan M, Ruzycky ME, Su G, Eastell R. The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2012 Feb;27(2):243-54. doi: 10.1002/jbmr.1494. Erratum in: J Bone Miner Res. 2012 Dec;27(12):2612. PMID: 22161728; PMCID: PMC3427916. LoE 1+ SIGN) im Vergleich zum Therapieabbruch. Für Denosumab liegen nach Ende der 3-jährigen randomisierten Wirksamkeits-Studie (Cummings SR et al. 2009 📖Cummings SR, San Martin J, McClung MR, Siris ES, Eastell R, Reid IR, Delmas P, Zoog HB, Austin M, Wang A, Kutilek S, Adami S, Zanchetta J, Libanati C, Siddhanti S, Christiansen C; FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009 Aug 20;361(8):756-65. doi: 10.1056/NEJMoa0809493. Epub 2009 Aug 11. Erratum in: N Engl J Med. 2009 Nov 5;361(19):1914. PMID: 19671655. LoE 1+ SIGN) Studiendaten über die Verlängerungsstudie (Bone HG et al. 2013 LoE 2- SIGN 📖Bone HG, Chapurlat R, Brandi ML, Brown JP, Czerwinski E, Krieg MA, Mellström D, Radominski SC, Reginster JY, Resch H, Ivorra JA, Roux C, Vittinghoff E, Daizadeh NS, Wang A, Bradley MN, Franchimont N, Geller ML, Wagman RB, Cummings SR, Papapoulos S. The effect of three or six years of denosumab exposure in women with postmenopausal osteoporosis: results from the FREEDOM extension. J Clin Endocrinol Metab. 2013 Nov;98(11):4483-92. doi: 10.1210/jc.2013-1597. Epub 2013 Aug 26. PMID: 23979955; PMCID: PMC4207950. LoE 2- SIGN) nach Cross-over der Placebogruppe und eine Nachbeobachtung zur Sicherheit mit anhaltend niedriger Frakturinzidenz bis 10 Jahre vor (Bone DM et al. 2017 📖Bone HG, Wagman RB, Brandi ML, Brown JP, Chapurlat R, Cummings SR, Czerwiński E, Fahrleitner-Pammer A, Kendler DL, Lippuner K, Reginster JY, Roux C, Malouf J, Bradley MN, Daizadeh NS, Wang A, Dakin P, Pannacciulli N, Dempster DW, Papapoulos S. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017 Jul;5(7):513-523. doi: 10.1016/S2213-8587(17)30138-9. Epub 2017 May 22. PMID: 28546097.). Unter langfristiger antiresorptiver Therapie soll regelmäßig das Risiko-Nutzen-Verhältnis überprüft werden. Romosozumab ist per Zulassung auf die Dauer von 12 Monaten pro Zyklus beschränkt. Teriparatid ist auf die Dauer von 24 Monaten beschränkt, wobei sich die Beschränkung der Zulassungsbehörde bei Teriparatid auf die gesamte Lebenszeit bezieht.
In diesem Unterkapitel sollen Präparate behandelt werden, für die außerhalb des generellen DVO-Konzeptes der vom absoluten Frakturrisiko abhängigen Therapieschwelle eine Zulassung und/oder eine besondere Datenlage besteht für spezielle Therapiesituationen. Hier geht es in erster Linie um die Prävention und Therapie medikamentenassoziierter Knochenschädigungen im Rahmen anderer Grunderkrankungen.
| Empfehlung | |
|
Für die spezifische Therapie der Glucocorticoid-assoziierten Osteoporose (GIOP) sollen Präparate mit entsprechender Zulassung verwendet werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 |
|
| Konsensstärke 16/16 starker Konsens |
|
| Belegende Evidenzen:
Allen CS, Yeung JH, Vandermeer B, Homik J. Bisphosphonates for steroid-induced osteoporosis. Cochrane Database Syst Rev. 2016 Oct 5; 10(10):CD001347. doi: 10.1002/14651858.CD001347.pub2. PMID: 27706804; PMCID: PMC6461188.LoE1 Saag KG, Shane E, Boonen S, Marín F, Donley DW, Taylor KA, Dalsky GP, Marcus R. Teriparatide or alendronate in glucocorticoid-induced osteoporosis. N Engl J Med. 2007 Nov 15;357(20):2028-39. doi: 10.1056/NEJMoa071408. PMID: 18003959. LoE 1+ SIGN Saag KG, Zanchetta JR, Devogelaer JP, Adler RA, Eastell R, See K, Krege JH, Krohn K, Warner MR. Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of a randomized, double-blind, controlled trial. Arthritis Rheum. 2009 Nov;60(11):3346-55. doi: 10.1002/art.24879. PMID: 19877063. LoE 1+ SIGN |
|
Zugelassene Präparate für die Therapie der Glucocorticoid-assoziierten Osteoporose (GlOP):
Alendronat (10mg p. o. täglich) ist zugelassen zur Prävention der Glucocorticoid-induzierten Osteoporose. In der zulassungsrelevanten Studie wurden Männer und Frauen im Alter von 17 bis 83 Jahren behandelt. Es liegen auch Studiendaten zu 5 mg Alendronat vor, jedoch ist diese Dosierung in Deutschland nicht verfügbar.
Denosumab (60 mg s. c. alle 6 Monate) ist zugelassen zur Behandlung von Knochenschwund im Zusammenhang mit systemischer Glucocorticoid-Langzeittherapie bei erwachsenen Patientinnen und Patienten mit erhöhtem Frakturrisiko. In der zulassungsrelevanten Studie wurden Männer und Frauen im Alter zwischen 20 und 94 Jahren untersucht.
Zoledronat (5mg i. v. alle 12 Monate) ist zugelassen zur Behandlung der Osteoporose in Zusammenhang mit einer systemischen Langzeit-Glucocorticoid-Therapie bei postmenopausalen Frauen und bei erwachsenen Männern mit einem erhöhten Frakturrisiko. In der zulassungsrelevanten Studie wurden Männer und Frauen zwischen 18 und 85 Jahren behandelt.
Risedronat (5mg p. o. täglich) ist formal zugelassen zum Erhalt oder zur Erhöhung der Knochenmasse bei postmenopausalen Frauen, die eine systemische Langzeitbehandlung (>3 Monate) mit Glucocorticoiden erhalten. Präparate mit dieser Dosierung sind derzeit in Deutschland nicht im Handel.
Teriparatid (20µg s. c. täglich für max. 24 Monate) ist zugelassen zur Behandlung der mit einer systemischen Langzeit-Glucocorticoid-Therapie assoziierten Osteoporose bei Frauen und Männern mit hohem Frakturrisiko. Für die zulassungsrelevante Studie wurden Frauen und Männer ab dem Alter von 21 Jahren rekrutiert.
Es besteht also bei Glucocorticoid-induzierter Osteoporose auch eine Zulassung für prämenopausale Frauen und Männer unter 60 Jahren, somit Patientengruppen, die in der vorliegenden Leitlinie als Adressaten nicht abgebildet werden.
Eine Glucocorticoid-Therapie ab einer Dosis von ≥2,5mg (Leipe J et al. 2021 📖Leipe J, Holle JU, Weseloh C, Pfeil A, Krüger K; die Kommission Pharmakotherapie der Deutschen Gesellschaft für Rheumatologie e. V. (DGRh). Empfehlungen der Deutschen Gesellschaft für Rheumatologie zum Management der Glucocorticoid-induzierten Osteoporose [German Society of Rheumatology Recommendations for the management of glucocorticoid-induced Osteoporosis. German version]. Z Rheumatol. 2021 Sep;80(7):670-687. German. doi: 10.1007/s00393-021-01028-w. Epub 2021 Aug 6. Erratum in: Z Rheumatol. 2022 Apr;81(3):263. PMID: 34357436., Van Staa T et al. 2000 📖van Staa TP, Geusens P, Bijlsma JW, Leufkens HG, Cooper C. Clinical assessment of the long-term risk of fracture in patients with rheumatoid arthritis. Arthritis Rheum. 2006 Oct;54(10):3104-12. Evidenzgrad 2b Oxford) oralem Prednisolonäquivalent über ≥3 Monate erhöht kontinuierlich und dosisabhängig das Frakturrisiko. Dies ist bereits bei der Einleitung einer solchen Therapie zu berücksichtigen.
Die Deutsche Gesellschaft für Rheumatologie hat 2021 eine systematische Literaturrecherche und darauf basierende strukturierte Konsensbildung für Empfehlungen zur Glucocorticoid-induzierten Osteoporose (GIOP) veröffentlicht (Leipe J et al. 2021 📖Leipe J, Holle JU, Weseloh C, Pfeil A, Krüger K; die Kommission Pharmakotherapie der Deutschen Gesellschaft für Rheumatologie e. V. (DGRh). Empfehlungen der Deutschen Gesellschaft für Rheumatologie zum Management der Glucocorticoid-induzierten Osteoporose [German Society of Rheumatology Recommendations for the management of glucocorticoid-induced Osteoporosis. German version]. Z Rheumatol. 2021 Sep;80(7):670-687. German. doi: 10.1007/s00393-021-01028-w. Epub 2021 Aug 6. Erratum in: Z Rheumatol. 2022 Apr;81(3):263. PMID: 34357436.). Eine Metaanalyse aus 2016 belegt klar den Nutzen von Bisphosphonaten zur Verhinderung vertebraler Frakturen und Steroid-induziertem Knochendichteverlust (Allen CS et al. 2016 📖Allen CS, Yeung JH, Vandermeer B, Homik J. Bisphosphonates for steroid-induced osteoporosis. Cochrane Database Syst Rev. 2016 Oct 5;10(10):CD001347. doi: 10.1002/14651858.CD001347.pub2. PMID: 27706804; PMCID: PMC6461188.). Prospektive, randomisierte Studien bei Patientinnen und Patienten unter Glucocorticoid-Therapie zum Vergleich der Antiresorptiva untereinander mit Frakturendpunktdaten sind nicht verfügbar. Zwei randomisierte Studien zeigen einen stärkeren Anstieg der Knochendichte unter Zoledronat (Reid IR et al. 2009 📖Reid DM, Devogelaer JP, Saag K, Roux C, Lau CS, Reginster JY, Papanastasiou P, Ferreira A, Hartl F, Fashola T, Mesenbrink P, Sambrook PN; HORIZON investigators. Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2009 Apr 11;373(9671):1253-63. doi: 10.1016/S0140-6736(09)60250-6. PMID: 19362675., Sambrook PN et al. 2012 📖Sambrook PN, Roux C, Devogelaer JP, Saag K, Lau CS, Reginster JY, Bucci-Rechtweg C, Su G, Reid DM. Bisphosphonates and glucocorticoid osteoporosis in men: results of a randomized controlled trial comparing zoledronic acid with risedronate. Bone. 2012 Jan;50(1):289-95. doi: 10.1016/j.bone.2011.10.024. Epub 2011 Oct 29. Erratum in: Bone. 2012 Mar;50(3):811. PMID: 22061864.) und eine Studie nach Wechsel auf Denosumab im Vergleich zu oralem Risedronat (Mok CC et al. 2015 📖Mok CC, Ho LY, Ma KM. Switching of oral bisphosphonates to denosumab in chronic glucocorticoid users: a 12-month randomized controlled trial. Bone. 2015 Jun;75:222-8. doi: 10.1016/j.bone.2015.03.002. Epub 2015 Mar 8. PMID: 25761434.). Eine weitere prospektive randomisierte Phase III-Studie zeigte eine Überlegenheit von Denosumab gegenüber Risedronat in Bezug auf Knochendichteanstiege an Wirbelsäule und Hüfte (Saag KG et al. 2019 📖Saag KG, Pannacciulli N, Geusens P, Adachi JD, Messina OD, Morales-Torres J, Emkey R, Butler PW, Yin X, Lems WF. Denosumab Versus Risedronate in Glucocorticoid-Induced Osteoporosis: Final Results of a Twenty-Four-Month Randomized, Double-Blind, Double-Dummy Trial. Arthritis Rheumatol. 2019 Jul;71(7):1174-1184. doi: 10.1002/art.40874. Epub 2019 May 25. PMID: 30816640; PMCID: PMC6619388., Saag KG et al. 2018 📖Saag KG, Wagman RB, Geusens P, Adachi JD, Messina OD, Emkey R, Chapurlat R, Wang A, Pannacciulli N, Lems WF. Denosumab versus risedronate in glucocorticoid-induced osteoporosis: a multicentre, randomised, double-blind, active-controlled, double-dummy, non-inferiority study. Lancet Diabetes Endocrinol. 2018 Jun;6(6):445-454. doi: 10.1016/S2213-8587(18)30075-5. Epub 2018 Apr 6. PMID: 29631782.). In einer prospektiven Vergleichsstudie zwischen Teriparatid und Alendronat zeigte sich eine signifikante Überlegenheit von Teriparatid bezüglich des primären Endpunktes (Knochendichte), jedoch auch bezüglich des sekundären Endpunktes vertebraler Frakturen (0,6 % vs. 6,1 %, P=0,004, relative Risikoreduktion 90 %) (Saag KG et al. 2007 📖Saag KG, Shane E, Boonen S, Marín F, Donley DW, Taylor KA, Dalsky GP, Marcus R. Teriparatide or alendronate in glucocorticoid-induced osteoporosis. N Engl J Med. 2007 Nov 15;357(20):2028-39. doi: 10.1056/NEJMoa071408. PMID: 18003959. LoE 1+ SIGN, Saag KG et al. 2009 📖Saag KG, Zanchetta JR, Devogelaer JP, Adler RA, Eastell R, See K, Krege JH, Krohn K, Warner MR. Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of a randomized, double-blind, controlled trial. Arthritis Rheum. 2009 Nov;60(11):3346-55. doi: 10.1002/art.24879. PMID: 19877063. LoE 1+SIGN) ohne Unterschiede bezüglich nichtvertebraler Frakturen. Eingeschlossen in die Studie wurden Erwachsene ab 21 Jahre unter ≥5mg Prednisolonäquivalent pro Tag ≥3 Monate mit T-Score der LWS oder Hüfte ≤-2,0 oder ≤-1,0 bei zusätzlicher Fragilitätsfraktur. Die mediane Prednisolondosis lag bei 7,5 mg bzw. 7,8 mg (Teriparatid bzw. Alendronat-Gruppe) über 1,5 bzw. 1,2 Jahre. Dies korrespondiert zu den Daten der VERO-Studie bei postmenopausalen Frauen ohne Glucocorticoid-Therapie (Geusens P et al. 2018 📖Geusens P, Marin F, Kendler DL, Russo LA, Zerbini CA, Minisola S, Body JJ, Lespessailles E, Greenspan SL, Bagur A, Stepan JJ, Lakatos P, Casado E, Moericke R, López-Romero P, Fahrleitner-Pammer A. Effects of Teriparatide Compared with Risedronate on the Risk of Fractures in Subgroups of Postmenopausal Women with Severe Osteoporosis: The VERO Trial. J Bone Miner Res. 2018 May;33(5):783-794. doi: 10.1002/jbmr.3384. Epub 2018 Feb 9. PMID: 29329484.).
| Empfehlung | |||
|
Bei Osteoporose-Patientinnen und -Patienten mit hohem Frakturrisiko unter geplanter/laufender Glucocorticoid-Terapie mit >5 mg Prednisolon/Tag >3 Monate sollte einer osteoanabolen Therapie mit Teriparatid gegenüber einer oralen Bisphosphonat-Therapie der Vorzug gegeben werden.
|
Empfehlungsgrad B |
||
| Evidenzgrad 1 |
|||
| Konsensstärke 19/20 (1 nein)-Konsens 17/18 (1 nein)*-Konsens |
|||
| Belegende Evidenzen:
Saag KG, Shane E, Boonen S, Marín F, Donley DW, Taylor KA, Dalsky GP, Marcus R. Teriparatide or alendronate in glucocorticoid-induced osteoporosis. N Engl J Med. 2007 Nov 15;357(20):2028-39. doi: 10.1056/NEJMoa071408. PMID: 18003959. LoE 1+ SIGN Saag KG, Zanchetta JR, Devogelaer JP, Adler RA, Eastell R, See K, Krege JH, Krohn K, Warner MR. Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of a randomized, double-blind, controlled trial. Arthritis Rheum. 2009 Nov;60(11):3346-55. doi: 10.1002/art.24879. PMID: 19877063. LoE 1+ SIGN |
|||
| Empfehlung | |
|
Frauen mit nicht-metastasiertem Brustkrebs sollte unter hormonablativer Therapie/Aromataseinhibitor-Therapie eine osteoprotektive Therapie mit Denosumab oder Bisphosphonaten in Osteoporosedosis angeboten werden, wenn nicht schon aus onkologischer Indikation eine adjuvante Bisphosphonattherapie durchgeführt wird.
|
Empfehlungsgrad B |
| Evidenzgrad 1 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenzen:
Gnant M, Pfeiler G, Dubsky PC, Hubalek M, Greil R, Jakesz R, Wette V, Balic M, Haslbauer F, Melbinger E, Bjelic-Radisic V, Artner-Matuschek S, Fitzal F, Marth C, Sevelda P, Mlineritsch B, Steger GG, Manfreda D, Exner R, Egle D, Bergh J, Kainberger F, Talbot S, Warner D, Fesl C, Singer CF; Austrian Breast and Colorectal Cancer Study Group. Adjuvant denosumab in breast cancer (ABCSG-18): a multicentre, randomised, double-blind, placebo-controlled trial. Lancet. 2015 Aug 1;386(9992):433-43. doi: 10.1016/S0140-6736(15)60995-3. Epub 2015 May 31. PMID: 26040499. LoE 2 Abdel-Rahman O. Denosumab versus zoledronic acid to prevent aromatase inhibitors-associated fractures in postmenopausal early breast cancer; a mixed treatment meta-analysis. Expert Rev Anticancer Ther. 2016 Aug;16(8):885-91. doi: 10.1080/14737140.2016.1192466. Epub 2016 Jun 1. PMID: 27210216. LoE 1 |
|
Relevant im Rahmen der Osteoporose-Leitlinie ist die Therapie und Prävention des/der durch die hormonablative Therapie/Aromataseinhibitor-Therapie induzierten Knochenmasseverlustes/Osteoporose. Hier handelt es sich per defintionem um postmenopausale Frauen, da Frauen, die medikamentös oder operativ eine Hormonablation erfahren, postmenopausalen Frauen gleichzusetzen sind. Für diese Fragestellung wurden in der Vergangenheit prospektive Therapiestudien durchgeführt. So konnte in einer prospektiven randomisierten Studie mit 3.420 Patientinnen gezeigt werden, dass Denosumab die Frakturinzidenz signifikant senken kann im Vergleich zu Placebo, sowohl bei Patientinnen mit T-Scores <-1 SD bei Einschluss als auch bei Patientinnen mit T-Scores >-1 SD (Gnant M et al. 2015 📖Gnant M, Pfeiler G, Dubsky PC, Hubalek M, Greil R, Jakesz R, Wette V, Balic M, Haslbauer F, Melbinger E, Bjelic-Radisic V, Artner-Matuschek S, Fitzal F, Marth C, Sevelda P, Mlineritsch B, Steger GG, Manfreda D, Exner R, Egle D, Bergh J, Kainberger F, Talbot S, Warner D, Fesl C, Singer CF; Austrian Breast and Colorectal Cancer Study Group. Adjuvant denosumab in breast cancer (ABCSG-18): a multicentre, randomised, double-blind, placebo-controlled trial. Lancet. 2015 Aug 1;386(9992):433-43. doi: 10.1016/S0140-6736(15)60995-3. Epub 2015 May 31. PMID: 26040499.). In einem systematischen Review und Metaanalyse zur Frage nach dem besten Antiresorptivum (Zoledronat versus Denosumab) und dem besten Zeitpunkt (sofort oder erst bei Knochendichteverlust) bei Aromataseinhibitor-assoziierter Osteoporose, konnte die beste Frakturrisikoreduktion für die Patientinnen mit sofortiger Denosumabtherapie gezeigt werden (Abdel-Rahman O et al. 2016 📖Abdel-Rahman O. Denosumab versus zoledronic acid to prevent aromatase inhibitors-associated fractures in postmenopausal early breast cancer; a mixed treatment meta-analysis. Expert Rev Anticancer Ther. 2016 Aug;16(8):885-91. doi: 10.1080/14737140.2016.1192466. Epub 2016 Jun 1. PMID: 27210216. LoE 1). Eine explizite Zulassung für diese Indikation besteht nicht, da die EMA Zulassungsbehörde davon ausgeht, dass diese Therapiesituation bereits durch die allgemeine Indikation (postmenopausale Frauen mit hohen Frakturrisiko) gedeckt ist.
Zur osteoprotektiven Therapie in der adjuvanten Therapiesituation beim Mammakarzinom liegen evidenzbasierte Empfehlungen der AGO Mamma (Arbeitsgemeinschaft Gynäkologische Onkologie e.V., www.ago-online.de, Osteoonkologie und Knochengesundheit; Stand: 01.03.2021) und die aktuelle ESMO-Leitlinie (Coleman R et al. 2020 📖Coleman R, Hadji P, Body JJ, Santini D, Chow E, Terpos E, Oudard S, Bruland Ø, Flamen P, Kurth A, Van Poznak C, Aapro M, Jordan K; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Bone health in cancer: ESMO Clinical Practice Guidelines. Ann Oncol. 2020 Dec;31(12):1650-1663. doi: 10.1016/j.annonc.2020.07.019. Epub 2020 Aug 12. PMID: 32801018.) vor. Sofern eine antiresorptive Therapie bereits im onkologischen Gesamtkonzept erfolgt, bedarf es keiner zusätzlichen antiresorptiven Therapie.
Zur Vermeidung von skelettalen Ereignissen (SRE) bei Brustkrebspatientinnen in der ossär-metastasierten Therapiesituation wird ausdrücklich auf die Empfehlungen der AGO Mamma und ESMO Leitlinie verwiesen. Auch in diesen Fällen ist keine zusätzliche osteoprotektive Therapie unter Aromataseinhibitortherapie indiziert.
| Empfehlung | |
|
Männern mit nicht-metastasiertem Prostatakarzinom sollte ab einem Alter von 70 Jahren bzw. auch schon in jüngerem Alter, wenn der minimale T-Score unter -1,0 liegt, unter antihormoneller Therapie eine osteoprotektive Behandlung mit Denosumab 60mg s.c. alle 6 Monate angeboten werden.
|
Empfehlungsgrad B |
| Evidenzgrad 1 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz:
Smith MR, Egerdie B, Hernández Toriz N, Feldman R, Tammela TL, Saad F, Heracek J, Szwedowski M, Ke C, Kupic A, Leder BZ, Goessl C; Denosumab HALT Prostate Cancer Study Group. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009 Aug 20;361(8):745-55. doi: 10.1056/NEJMoa0809003. Epub 2009 Aug 11. PMID: 19671656; PMCID: PMC3038121. LoE 1+SIGN |
|
Für Denosumab (60mg s.c. alle 6 Monate) besteht eine Zulassung zur Behandlung von Knochenschwund im Zusammenhang mit Hormonablation bei Männern mit Prostatakarzinom mit erhöhtem Frakturrisiko. In der zulassungsrelevanten Studie wurden 1.468 Männer im Alter von 48 bis 97 Jahren behandelt. Das erhöhte Frakturrisiko war definiert als > Alter 70 Jahre oder Alter < 70 Jahre mit einem BMD-T-Score < – 1,0 an der Lendenwirbelsäule, der Gesamthüfte oder am Schenkelhals oder einer vorbestehenden osteoporotischen Fraktur. Denosumab führte zu einer signifikanten Reduktion des relativen Risikos für neue vertebrale Frakturen: 85 % nach 1 Jahr, 69 % nach 2 Jahren und 62 % nach 3 Jahren (Smith MR et al. 2009 📖Smith MR, Egerdie B, Hernández Toriz N, Feldman R, Tammela TL, Saad F, Heracek J, Szwedowski M, Ke C, Kupic A, Leder BZ, Goessl C; Denosumab HALT Prostate Cancer Study Group. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009 Aug 20;361(8):745-55. doi: 10.1056/NEJMoa0809003. Epub 2009 Aug 11. PMID: 19671656; PMCID: PMC3038121. LoE 1+SIGN). Zwei Metaanalysen konnten zeigen, dass bei Männern mit Prostatakarzinom unter antiandrogener Therapie die Knochendichte durch die Gabe von Bisphosphonaten bzw. Denosumab verbessert werden kann (Alibhai SMH et al. 2017 📖Alibhai SMH, Zukotynski K, Walker-Dilks C, Emmenegger U, Finelli A, Morgan SC, Hotte SJ, Tomlinson GA, Winquist E. Bone Health and Bone-Targeted Therapies for Nonmetastatic Prostate Cancer: A Systematic Review and Meta-analysis. Ann Intern Med. 2017 Sep 5;167(5):341-350. doi: 10.7326/M16-2577. Epub 2017 Aug 8. PMID: 28785760. LoE 1; Poon Y et al. 2018 📖Poon Y, Pechlivanoglou P, Alibhai SMH, Naimark D, Hoch JS, Papadimitropoulos E, Hogan ME, Krahn M. Systematic review and network meta-analysis on the relative efficacy of osteoporotic medications: men with prostate cancer on continuous androgen-deprivation therapy to reduce risk of fragility fractures. BJU Int. 2018 Jan;121(1):17-28. doi: 10.1111/bju.14015. Epub 2017 Oct 15. PMID: 28921820. LoE 1). Für Bisphosphonate konnte keine Überlegenheit gegenüber Placebo hinsichtlich Frakturendpunkten gezeigt werden.
Wurde die Diagnose Osteoporose gestellt und das individuelle Frakturrisiko als so hoch berechnet, dass neben der Basistherapie auch eine spezifische medikamentöse Therapie indiziert ist (Kapitel 9.4.), dann soll ein individueller Therapieplan erstellt werden. Dabei sollen verschiedene Aspekte berücksichtigt werden, die im Folgenden ausgeführt werden. Grundsätzlich sollen nur zugelassene Medikamente mit hoher Empfehlungsstärke zum Einsatz kommen (siehe Kap 9.5.1).
| Empfehlung | |
|
Für die spezifische Therapie sollen Präparate mit hoher Empfehlungsstärke verwendet werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenzen:
Cosman F, Crittenden DB, Adachi JD, Binkley N, Czerwinski E, Ferrari S, Hofbauer LC, Lau E, Lewiecki EM, Miyauchi A, Zerbini CA, Milmont CE, Chen L, Maddox J, Meisner PD, Libanati C, Grauer A. Romosozumab Treatment in Postmenopausal Women with Osteoporosis. N Engl J Med. 2016 Oct 20;375(16):1532-1543. doi: 10.1056/NEJMoa1607948. Epub 2016 Sep 18. PMID: 27641143. LoE 2 Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-1427. doi: 10.1056/NEJMoa1708322. Epub 2017 Sep 11. PMID: 28892457. LoE 2 |
|
In der überwiegenden Zahl der Fälle ist Osteoporose eine chronische Erkrankung und in diesen Fällen dann auch langfristig therapiebedürftig. Das Frakturrisiko bestimmt die Dauer der spezifischen Osteoporose-Therapie. Die Erhöhung des Frakturrisikos durch Risikofaktoren ist nach dem Wegfall des Risikofaktors innerhalb von ein bis zwei Jahren vermutlich reversibel. Das Frakturrisiko kann unter spezifischer Therapie abfallen (z. B. durch Wegfall von veränderbaren Risikofaktoren und/oder Anstieg der Knochendichte), gleichbleiben, oder weiter ansteigen (z. B. zunehmendes Alter, neu aufgetretene Frakturen, Auftreten neuer Risikofaktoren). Bei geeigneten Patientinnen und Patienten kann die Therapie daher im Verlauf unterbrochen/abgesetzt werden, bei anderen mit anhaltend hohem Risiko ist ein Therapieabbruch riskant, sodass die spezifische Therapie fortzuführen bzw. auf ein anderes Präparat zu wechseln ist. Nur Bisphosphonate haben einen fraktursenkenden Effekt, der über die Dauer der Therapie hinausgeht. Dieser „Speichereffekt“ ist strukturabhängig unterschiedlich. Als langwirksam können Alendronat, und Zoledronat gelten (Cremers S et al. 2019 📖Cremers S, Drake MT, Ebetino FH, Bilezikian JP, Russell RGG. Pharmacology of bisphosphonates. Br J Clin Pharmacol. 2019 Jun;85(6):1052-1062. doi: 10.1111/bcp.13867. Epub 2019 Feb 28. PMID: 30650219; PMCID: PMC6533426., Lawson et al. 2010 📖Lawson MA, Xia Z, Barnett BL, Triffitt JT, Phipps RJ, Dunford JE, Locklin RM, Ebetino FH, Russell RG. Differences between bisphosphonates in binding affinities for hydroxyapatite. J Biomed Mater Res B Appl Biomater. 2010 Jan;92(1):149-55. doi: 10.1002/jbm.b.31500. PMID: 19904734.). Alle anderen Medikamente verlieren rasch ihre Wirkung und benötigen eine Anschlusstherapie. Daher sind bereits bei erster Therapieinitiierung Nebenwirkungen und Zusatzwirkungen, Kontraindikationen, Applikationsformen, Kosten und notwendige Sequenzen im Idealfall zu berücksichtigen. Dies inkludiert die Bestimmung individueller Therapieziele. Dazu gehören Verbesserung und Erhalt der Autonomie und Funktionalität (Aktivitäten des täglichen Lebens), die vor allem durch die Verhinderung von Frakturen, also das Absenken des individuellen Frakturrisikos, erreicht werden können (Thomas T et al. 2020 📖Thomas T, Casado E, Geusens P, Lems WF, Timoshanko J, Taylor D, Hofbauer LC. Is a treat-to-target strategy in osteoporosis applicable in clinical practice? Consensus among a panel of European experts. Osteoporos Int. 2020 Dec;31(12):2303-2311. doi: 10.1007/s00198-020-05569-9. Epub 2020 Aug 7. PMID: 32767094; PMCID: PMC7661407., Cummings SR et al. 2017 📖Cummings SR, Cosman F, Lewiecki EM, Schousboe JT, Bauer DC, Black DM, Brown TD, Cheung AM, Cody K, Cooper C, Diez-Perez A, Eastell R, Hadji P, Hosoi T, Jan De Beur S, Kagan R, Kiel DP, Reid IR, Solomon DH, Randall S. Goal-Directed Treatment for Osteoporosis: A Progress Report From the ASBMR-NOF Working Group on Goal-Directed Treatment for Osteoporosis. J Bone Miner Res. 2017 Jan;32(1):3-10. doi: 10.1002/jbmr.3039. Epub 2016 Dec 27. PMID: 27864889.). Hinsichtlich Applikationsform ist zu berücksichtigen, dass für das orale Bisphosphonat Risedronat zwei Applikationsformen vorliegen, wovon die magensaftresistente Formulierung (verzögerte Freisetzung) nach dem Frühstück eingenommen wird. Es liegen Daten einer Äquivalenzstudie zu Risedronat 5 mg/Tag vor hinsichtlich Effektivität und Nebenwirkungsprofil (McClung 2012 und 2013) 📖McClung, M. R., Miller, P. D., Brown, J. P., et al. & Recker, R. R. (2012). Efficacy and safety of a novel delayed-release risedronate 35 mg once-a-week tablet. Osteoporosis International, 23, 267-276. McClung, M. R., Balske, A., Burgio, D. E., Wenderoth, D., & Recker, R. R. (2013). Treatment of postmenopausal osteoporosis with delayed-release risedronate 35 mg weekly for 2 years. Osteoporosis International, 24, 301-310., die belegen, dass das magensaftresistente Risedronat 35 mg/Woche bei Einnahme nach dem Frühstück zu äquivalenten Knochendichteveränderungen und Suppression der Knochenumbauparameter im Vergleich zu Risedronat 5 mg führt.
Durch die Definition individueller Therapieziele ergeben sich Konsequenzen für die Auswahl der medikamentösen und nicht-medikamentösen Therapie, für das Therapiemonitoring und das Assessment der Therapieadhärenz.
| Empfehlung | |
|
Für die gemeinsame Entscheidung (shared decision) zur Auswahl des individuell geeigneten Präparates sollen die individuellen Therapieziele, Kontraindikationen, die z. T. unterschiedliche fraktursenkende Wirksamkeit, die möglichen Nebenwirkungen und zusätzlichen Wirkungen, die Applikationsformen, die Kosten und notwendigen Sequenzen berücksichtigt werden.
|
Empfehlungsgrad A |
| Evidenzgrad Expertenkonsens |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenzen:
Thomas T, Casado E, Geusens P, Lems WF, Timoshanko J, Taylor D, Hofbauer LC. Is a treat-to-target strategy in osteoporosis applicable in clinical practice? Consensus among a panel of European experts. Osteoporos Int. 2020 Dec;31(12):2303-2311. doi: 10.1007/s00198-020-05569-9. Epub 2020 Aug 7. PMID: 32767094; PMCID: PMC7661407. Cummings SR, Cosman F, Lewiecki EM, Schousboe JT, Bauer DC, Black DM, Brown TD, Cheung AM, Cody K, Cooper C, Diez-Perez A, Eastell R, Hadji P, Hosoi T, Jan De Beur S, Kagan R, Kiel DP, Reid IR, Solomon DH, Randall S. Goal-Directed Treatment for Osteoporosis: A Progress Report From the ASBMR-NOF Working Group on Goal-Directed Treatment for Osteoporosis. J Bone Miner Res. 2017 Jan;32(1):3-10. doi: 10.1002/jbmr.3039. Epub 2016 Dec 27. PMID: 27864889. |
|
Wesentliche Kontraindikationen für orale Bisphosphonate sind Anomalien des Ösophagus, Unfähigkeit, für mindestens 30 Minuten aufrecht zu stehen oder zu sitzen, und Hypocalcämie, für intravenöse Bisphosphonate Hypokalzämie und schwere Nierenfunktionsstörung, für Denosumab Hypokalzämie, für Raloxifen venöse thromboembolische Ereignisse, eingeschränkte Leberfunktion einschließlich Cholestase, schwere Nierenschädigung, ungeklärte Uterusblutungen und klinischen Zeichen eines Endometriumkarzinoms, für Romosozumab Hypokalzämie sowie Myokardinfarkt oder Schlaganfall in der Historie, und für Teriparatid vorbestehende Hyperkalzämie, schwere Niereninsuffizienz, metabolische Knochenkrankheiten (einschließlich Hyperparathyreoidismus und Paget-Krankheit), ungeklärte Erhöhung der alkalischen Phosphatase, vorausgegangene Strahlentherapie, bei der das Skelett im Strahlenfeld lag, und maligne Skeletterkrankungen oder Knochenmetastasen.
Diesbezüglich und auch bezüglich anderer Warnhinweise und der Nebenwirkungen wird auf die jeweilig aktualisierte Fachinformation der Präparate verwiesen.
Bezüglich zusätzlicher Wirkungen und unerwünschter Wirkungen der verschiedenen Therapeutika wird auch auf das Kapitel 9.5.8. dieser Leitlinie verwiesen.
| Empfehlung | |
|
Bei einem absoluten Frakturrisiko oberhalb der osteoanabolen Schwelle (ab 10 %/3 Jahreà DVO-Risikorechner) soll eine osteoanabol wirksame Substanz (Teriparatid oder Romosozumab) empfohlen werden*.
* unter Beachtung des Zulassungsstatus und der Kontraindikationen Sondervotum der DEGAM: Eine spezifische medikamentöse Therapie mit osteoanabol wirksamen Substanzen (Romosozumab oder Teriparatid) sollte ab einem 3-Jahres-Frakturrisiko von 10 % für Schenkelhalsfrakturen und Wirbelkörperfrakturen empfohlen werden. Empfehlungsgrad B |
Evidenzgrad 1 |
| Empfehlungsgrad A |
|
| Konsensstärke 17 von 18 Konsens |
|
| Belegende Evidenzen:
Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-1427. doi: 10.1056/NEJMoa1708322. Epub 2017 Sep 11. PMID: 28892457. LoE 2 Kendler DL, Marin F, Zerbini CAF, Russo LA, Greenspan SL, Zikan V, Bagur A, Malouf-Sierra J, Lakatos P, Fahrleitner-Pammer A, Lespessailles E, Minisola S, Body JJ, Geusens P, Möricke R, López-Romero P. Effects of teriparatide and risedronate on new fractures in post-menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018 Jan 20;391(10117):230-240. doi: 10.1016/S0140-6736(17)32137-2. Epub 2017 Nov 9. Erratum in: Lancet. 2017 Nov 30;: Erratum in: Lancet. 2018 Dec 1;392(10162):2352. PMID: 29129436.LoE2 Begründung Sondervotum der DEGAM s. Kapitel 9.4. |
|
| Empfehlung | |
|
Bei einem absoluten Frakturrisiko oberhalb der Therapieschwelle und unterhalb der osteoanabolen Schwelle (zwischen 5 und 10 %/3 Jahre) kann der Einsatz einer osteoanabol wirksamen Substanz (Teriparatid oder Romosozumab) erwogen werden*.
* unter Beachtung des Zulassungsstatus und der Kontraindikationen |
Evidenzgrad 1 |
| Empfehlungsgrad 0 |
|
| Konsensstärke 19 von 19 Starker Konsens |
|
| Belegende Evidenzen:
Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-1427. doi: 10.1056/NEJMoa1708322. Epub 2017 Sep 11. PMID: 28892457. LoE 2 Kendler DL, Marin F, Zerbini CAF, Russo LA, Greenspan SL, Zikan V, Bagur A, Malouf-Sierra J, Lakatos P, Fahrleitner-Pammer A, Lespessailles E, Minisola S, Body JJ, Geusens P, Möricke R, López-Romero P. Effects of teriparatide and risedronate on new fractures in post-menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018 Jan 20;391(10117):230-240. doi: 10.1016/S0140-6736(17)32137-2. Epub 2017 Nov 9. Erratum in: Lancet. 2017 Nov 30; Erratum in: Lancet. 2018 Dec 1;392(10162):2352. PMID: 29129436. LoE2 |
|
| Empfehlung | |
|
Insbesondere bei der Entscheidung für oder gegen eine osteoanabol wirksame Therapie mit Teriparatid oder Romosozumab sollen das Risiko für eine imminente Fraktur sowie Faktoren der Gebrechlichkeit*, Komorbiditäten, Allgemeinzustand und Lebenserwartung berücksichtigt werden, dies gilt besonders im höheren Alter. * z.B. erfassbar durch TUG > 12 Sek. |
Evidenzgrad ExpertenkonsensEmpfehlungsgrad A |
| Konsensstärke Mit *16 ja /1 nein Ohne * 1 ja Konsens |
|
Eine prospektive randomisierte Studie (VERO) verglich 24 Monate Therapie mit Teriparatid mit Risedronat bei postmenopausalen Frauen mit mindestens einer schweren oder mindestens 2 moderaten vertebralen Frakturen in der Vorgeschichte und einem T-Score ≤ -1,5. Ein Drittel der Studienpopulation hatte innerhalb der 12 Monate vor Studieneinschluss eine vertebrale Fraktur erlitten, durchschnittlich hatten alle eingeschlossenen Patientinnen 2,7 prävalente vertebrale Frakturen. Bei diesen Patientinnen mit hohem Frakturrisiko zeigte sich Teriparatid dem oralen Bisphosphonat signifikant überlegen bezüglich vertebraler (12 % versus 5 %, relative Risikoreduktion 58 %, P<0,0001) und klinischer (10 % versus 5 %, relative Risikoreduktion 50 %, P=0,0009) Frakturen. Die Frakturrisikoreduktion nicht-vertebraler Frakturen (Hazard Ratio 0,66) war nicht signifikant (Kendler DL et al. 2018 📖Kendler DL, Marin F, Zerbini CAF, Russo LA, Greenspan SL, Zikan V, Bagur A, Malouf-Sierra J, Lakatos P, Fahrleitner-Pammer A, Lespessailles E, Minisola S, Body JJ, Geusens P, Möricke R, López-Romero P. Effects of teriparatide and risedronate on new fractures in post-menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018 Jan 20;391(10117):230-240. doi: 10.1016/S0140-6736(17)32137-2. Epub 2017 Nov 9. Erratum in: Lancet. 2017 Nov 30;: Erratum in: Lancet. 2018 Dec 1;392(10162):2352. PMID: 29129436. LoE 2). Darüber hinaus gibt es weitere gute Evidenz für die situative Überlegenheit der anabolen Therapie mit Teriparatid in head-to-head Studien mit Endpunkt Fraktur bei Glucocorticoid-induzierter Osteoporose (Panico A et al. 2011 📖Panico A, Lupoli GA, Marciello F, Lupoli R, Cacciapuoti M, Martinelli A, Granieri L, Iacono D, Lupoli G. Teriparatide vs. alendronate as a treatment for osteoporosis: changes in biochemical markers of bone turnover, BMD and quality of life. Med Sci Monit. 2011 Aug;17(8):CR442-448. doi: 10.12659/msm.881905. PMID: 21804463; PMCID: PMC3539612., Laura I et al. 2021 📖Laura I, Felicia B, Alexia C, Aude M, Florence B, Murielle S, Rafik K, Jean-Jacques B, Pierre B. Which treatment to prevent an imminent fracture? Bone Rep. 2021 Jul 9;15:101105. doi: 10.1016/j.bonr.2021.101105. PMID: 34386562; PMCID: PMC8342786.) und Endpunkt Surrogatparameter Knochendichte. https://www.ncbi.nlm.nih.gov/books/NBK558522/https://doi.org/10.1016/j.bone.2019.115081Eine randomisierte Vergleichsstudie zwischen Risedronat und Teriparatid bezüglich der Verringerung von Rückenschmerzen bei Patientinnen mit manifester Osteoporose und Z. n. vertebralen Frakturen hatte eine effektivere Reduktion der Inzidenz vertebraler Frakturen für Teriparatid als für Risedronat gezeigt (Hadji P et al. 2012 📖Hadji P, Zanchetta JR, Russo L, Recknor CP, Saag KG, McKiernan FE, Silverman SL, Alam J, Burge RT, Krege JH, Lakshmanan MC, Masica DN, Mitlak BH, Stock JL. The effect of teriparatide compared with risedronate on reduction of back pain in postmenopausal women with osteoporotic vertebral fractures. Osteoporos Int. 2012 Aug;23(8):2141-50. doi: 10.1007/s00198-011-1856-y. Epub 2011 Dec 13. PMID: 22159672.). Frakturen wurden in dieser Studie rein explorativ erfasst. Ein großer Teil der Patientinnen und Patienten in dieser Studie war mit Bisphosphonaten vorbehandelt. In einer Real-World Beobachtungsstudie an 323 Patientinnen mit schwerer Osteoporose konnte über einen Zeitraum von 5,5 Jahren ebenfalls eine signifikant niedrigere Rate vertebraler Frakturen detektiert werden, wenn die Patientinnen mit Teriparatid behandelt wurden (gegenüber standard care) (Oswald AJ et al. 2014). Die Therapiehinweise (Empfehlungen zur wirtschaftlichen Verordnungsweise) des Gemeinsamen Bundesausschusses (GBA) vom 21.11.2006 (BAnz. 2007, Nr. 58 S. 3121) wurden aufgrund der Ergebnisse der VERO-Studie durch den Beschluss vom 17.01.2019 aufgehoben (BAnz AT 05.04.2019 B3). Der Gemeinsame Bundesausschuss (G-BA) hat in seiner Sitzung am 17.01.2019 das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) beauftragt, eine vergleichende Nutzenbewertung von Bisphosphonaten, Teriparatid und Denosumab zur Behandlung der postmenopausalen Osteoporose durchzuführen. Im Abschlussbericht (Nummer A19-10) stellt das IQWiG in der endpunktübergreifenden Gesamtabwägung einen Anhaltspunkt für einen höheren Nutzen von Teriparatid gegenüber Risedronat fest. Die Zulassung besteht für Männer und für Frauen mit einem hohen Frakturrisiko. Es stehen Biosimiliars zur Verfügung, für die gleiche Wirkungen zu erwarten sind.
Romosozumab wurde bei postmenopausalen Frauen im Alter von 55-90 Jahren mit schwerer Osteoporose (T-Score ≤ -2,5 an Gesamtfemur oder Femurhals plus entweder ≥1 moderate/schwere oder ≥2 milde Wirbelkörperfrakturen oder proximale Femurfraktur 3 bis 24 Monate vor Studieneinschluss) über 12 Monate mit Alendronat verglichen, die Therapie wurde in beiden Gruppen mit Alendronat fortgesetzt (Saag KG et al. 2017 📖Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-1427. doi: 10.1056/NEJMoa1708322. Epub 2017 Sep 11. PMID: 28892457. LoE 2). Die primären Endpunkte der Studie – „neue vertebrale Fraktur“ (11,9 % versus 6,2 %, relative Risikoreduktion 48 %, P<0,001) und „neue klinische Fraktur“ (13,0 % versus 9,7 %, relative Risikoreduktion 27 %, P<0,001) – wurden signifikant erreicht. Auch bezüglich Hüftfrakturen (3,2 % versus 2 %, relative Risikoreduktion 38 %, P=0,02) und nicht-vertebralen Frakturen (10,6 % versus 8,7 %, relative Risikoreduktion 19 %, P=0,04) war Romosozumab der alleinigen Therapie mit Alendronat in der Frakturrisikoreduktion signifikant überlegen.
Im Kollektiv mit moderatem/niedrigem Risiko (-3,5<T-Score<-2,5) zeigt sich eine signifikante Reduktion vertebraler Frakturen unter Romosozumab im Vergleich zu Placebo (Denosumab-Anschlusstherapie) (Cosman F et al. 2016 📖Cosman F, Crittenden DB, Adachi JD, Binkley N, Czerwinski E, Ferrari S, Hofbauer LC, Lau E, Lewiecki EM, Miyauchi A, Zerbini CA, Milmont CE, Chen L, Maddox J, Meisner PD, Libanati C, Grauer A. Romosozumab Treatment in Postmenopausal Women with Osteoporosis. N Engl J Med. 2016 Oct 20;375(16):1532-1543. doi: 10.1056/NEJMoa1607948. Epub 2016 Sep 18. PMID: 27641143. LoE 2), jedoch nicht bei nicht-vertebralen Frakturen. Letzteres scheint begründet zu sein durch Teilnehmerinnen und Teilnehmer aus Lateinamerika, die ein eher niedriges absolutes Frakturrisiko bei Studieneinschluss hatten, was eine unerwartet niedrige Frakturrate in der Placebogruppe bedingte. Die Anwendung einer einjährigen Therapie mit Romosozumab, gefolgt von einer Erhaltungstherapie mit Denosumab, ist, bezogen auf die erreichte Steigerung der Knochendichte, einer Monotherapie mit Denosumab überlegen. Sie erreicht schneller eine Zielgröße und damit eine Frakturreduktion (Laura I et al. 2021 📖Laura I, Felicia B, Alexia C, Aude M, Florence B, Murielle S, Rafik K, Jean-Jacques B, Pierre B. Which treatment to prevent an imminent fracture? Bone Rep. 2021 Jul 9;15:101105. doi: 10.1016/j.bonr.2021.101105. PMID: 34386562; PMCID: PMC8342786.). Romosozumab, gefolgt von einer antiresorptiven Erhaltungstherapie, ist unabhängig von der Schwere des Krankheitsbildes frakturwirksam und der Monotherapie mit einem Antiresorptivum hinsichtlich des Surrogatparameters Knochendichte überlegen. Bezüglich der Knochendichte an LWS und Hüfte war Romosozumab Denosumab nach 12 Monaten überlegen (Kobayakawa T et al. 2021 📖Kobayakawa T, Miyazaki A, Saito M, Suzuki T, Takahashi J, Nakamura Y. Denosumab versus romosozumab for postmenopausal osteoporosis treatment. Sci Rep. 2021 Jun 3;11(1):11801. doi: 10.1038/s41598-021-91248-6. PMID: 34083636; PMCID: PMC8175428.). Ebenfalls auf den Surrogatparameter Knochendichte bezogen, erreicht die Therapie mit Romosozumab, gefolgt von Denosumab (nicht direkt), verglichen mit einer Denosumab-Monotherapie einen entsprechenden Zuwachs an Knochendichte um mehr als vier Jahre früher (Cosman F et al. 2018 📖Cosman F, Crittenden DB, Ferrari S, Khan A, Lane NE, Lippuner K, Matsumoto T, Milmont CE, Libanati C, Grauer A. FRAME Study: The Foundation Effect of Building Bone With 1 Year of Romosozumab Leads to Continued Lower Fracture Risk After Transition to Denosumab. J Bone Miner Res. 2018 Jul;33(7):1219-1226. doi: 10.1002/jbmr.3427. Epub 2018 May 17. PMID: 29573473.). Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hat in seiner ersten Nutzenbewertung (Dossierbewertung A20-24 vom 10.06.2020; www.iqwig.de) für postmenopausale Frauen mit manifester Osteoporose und deutlich erhöhtem Frakturrisiko einen Hinweis auf einen beträchtlichen Zusatznutzen von Romosozumab gegenüber der zweckmäßigen Vergleichstherapie Alendronsäure festgestellt. Der Gemeinsame Bundesausschuss (G-BA) hat das IQWiG am 28.07.2020 mit ergänzenden Bewertungen beauftragt. Im Addendum (IQWiG-Bericht Nr. 959, Auftrag A20-67 vom 14.08.2020) wurden unter anderem die Nebenwirkungen nochmals genauer bewertet. Für adjudizierte jegliche kardiovaskukäre Ereignisse, kardiovaskuläre ischämische Ereignisse, Tod, Herzinsuffizienz, nicht-koronare Revaskularisierung und peripheres vaskuläre ischämisches Ereignis konnte kein höherer oder geringerer Schaden belegt werden. Jedoch ergab sich ein Hinweis auf einen höheren Schaden von geringem Ausmaß für den Endpunkt zerebrovaskuläres Ereignis. Demgegenüber stehen 2 positive Effekte, ein Hinweis auf einen geringen Zusatznutzen für den Endpunkt major, nicht-vertebrale Frakturen sowie ein Hinweis auf einen beträchtlichen Zusatznutzen für den Endpunkt der klinischen vertebralen Frakturen. Der negative Effekt für den Endpunkt zerebrovaskuläres Ereignis führte zu einer Herabstufung des Ausmaßes des Zusatznutzens. Der Gemeinsame Bundesauschuss hat am 03.09.2020 eine Änderung der Arzneimittel-Richtlinie Anlage XII beschlossen und hat in einer Abwägungsentscheidung von Nutzen und Risiko einen Hinweis für einen geringen Zusatznutzen festgestellt (BAnz AT 05.10.2020 B3). Die Zulassung besteht für postmenopausale Frauen mit manifester Osteoporose und deutlich erhöhtem Frakturrisiko.
Die Surrogatparameter Knochendichte und Knochenumbaumarker sind in nahezu allen Zulassungsstudien untersucht worden. Aufgrund des Zusammenhanges zwischen Veränderung dieser Surrogatparameter und der Auswirkung der Medikation auf die Frakturrate ist es sinnvoll, zum Vergleich von Präparaten auch Studiendaten mit Surrogatparameter darzustellen und zu bewerten. Für die Zunahme der Knochendichte unter antiosteoporotischer Therapie konnte in einer großen Meta-Regressions-Studie ein klarer Zusammenhang zwischen Knochendichteveränderung und Hüft- und Wirbelkörperfrakturrisikoreduktion gezeigt werden (Bouxsein ML et al. 2019, LoE 1 📖Bouxsein ML, Eastell R, Lui LY, Wu LA, de Papp AE, Grauer A, Marin F, Cauley JA, Bauer DC, Black DM; FNIH Bone Quality Project. Change in Bone Density and Reduction in Fracture Risk: A Meta-Regression of Published Trials. J Bone Miner Res. 2019 Apr;34(4):632-642. doi: 10.1002/jbmr.3641. Epub 2019 Jan 23. PMID: 30674078. LoE 1), siehe auch Kapitel 6.1. Dies unterstützt die Annahme, dass Knochendichte als Surrogatparameter für Frakturrisiko in Therapiestudien verwendet werden kann, wohl wissend, dass die Ergebnisse nicht direkt dafür verwendet werden können, bei der individuellen Patientin den Therapieerfolg vorherzusagen.
Für intravenöse Bisphosphonate und Denosumab gibt es keine vollständig publizierten randomisierten kontrollierten Studien zum Vergleich mit anderen Therapeutika mit dem primären Endpunkt von Frakturen. Eine Mixed Treatment Comparison Analyse zeigt eine höhere Effektivität von Denosumab bezüglich der Reduktion vertebraler Frakturen bei Frauen gegenüber den oralen Bisphosphonaten und Raloxifen (Freemantle N et al. 2013). Die Interpretation dieser Studie ist eingeschränkt dadurch, dass sich die zum Vergleich herangezogenen Studien zum Teil sehr deutlich in der Calcium- und Vitamin D-Versorgung unterscheiden und sich der Vergleich mit der FIT-Studie auf eine Anfangsdosis von 5 mg Alendronat täglich bezieht. In einer großen prospektiven dänischen Register-Studie (92.355 Patientinnen) war in Bezug auf das Frakturrisiko für Hüftfrakturen und alle Frakturen kein Unterschied zwischen Denosumab und Alendronat-Therapie erkennbar (Pedersen AB et al. 2019 📖Pedersen AB, Heide-Jørgensen U, Sørensen HT, Prieto-Alhambra D, Ehrenstein V. Comparison of Risk of Osteoporotic Fracture in Denosumab vs Alendronate Treatment Within 3 Years of Initiation. JAMA Netw Open. 2019 Apr 5;2(4):e192416. doi: 10.1001/jamanetworkopen.2019.2416. PMID: 31002319; PMCID: PMC6481596.). Raloxifen war in vergleichenden Studien gleichermaßen effektiv wie Alendronat und ebenso sicher (Kim Y et al. 2020 📖Kim Y, Tian Y, Yang J, Huser V, Jin P, Lambert CG, Park H, You SC, Park RW, Rijnbeek PR, Van Zandt M, Reich C, Vashisht R, Wu Y, Duke J, Hripcsak G, Madigan D, Shah NH, Ryan PB, Schuemie MJ, Suchard MA. Comparative safety and effectiveness of alendronate versus raloxifene in women with osteoporosis. Sci Rep. 2020 Jul 6;10(1):11115. doi: 10.1038/s41598-020-68037-8. PMID: 32632237; PMCID: PMC7338498.., Khalid S et al. 2018 📖Khalid S, Calderon-Larrañaga S, Hawley S, Ali MS, Judge A, Arden N, van Staa T, Cooper C, Javaid MK, Prieto-Alhambra D. Comparative anti-fracture effectiveness of different oral anti-osteoporosis therapies based on “real-world” data: a meta-analysis of propensity-matched cohort findings from the UK Clinical Practice Research Database and the Catalan SIDIAP Database. Clin Epidemiol. 2018 Oct 9;10:1417-1431. doi: 10.2147/CLEP.S164112. PMID: 30349390; PMCID: PMC6183551.). Real World Daten zeigten für Raloxifen sogar einen Vorteil gegenüber Alendronat (RR Hüftfrakturen 0,75, Major Osteoporotic Fractures 0,77 (Khalid S et al. 2018 📖Khalid S, Calderon-Larrañaga S, Hawley S, Ali MS, Judge A, Arden N, van Staa T, Cooper C, Javaid MK, Prieto-Alhambra D. Comparative anti-fracture effectiveness of different oral anti-osteoporosis therapies based on “real-world” data: a meta-analysis of propensity-matched cohort findings from the UK Clinical Practice Research Database and the Catalan SIDIAP Database. Clin Epidemiol. 2018 Oct 9;10:1417-1431. doi: 10.2147/CLEP.S164112. PMID: 30349390; PMCID: PMC6183551.). Eine Metaanalyse von Studien (RCTs) für den Vergleich zwischen Denosumab und Bisphosphonaten (Alendronat, Risedronat, Ibandronat, Zoledronat) erbrachte einen Vorteil für Denosumab in Bezug auf die Knochendichte. Nach 12 Monaten Beobachtung zeigte sich kein Unterschied in der Fraktur-Inzidenz, nach 24 Monaten ergab sich ein Vorteil für Denosumab (Risk Ratio 0,51) (Lyu H et al. 2018 📖Lyu H, Jundi B, Xu C, Tedeschi SK, Yoshida K, Zhao S, Nigwekar SU, Leder BZ, Solomon DH. Comparison of Denosumab and Bisphosphonates in Patients With Osteoporosis: A Meta-Analysis of Randomized Controlled Trials. J Clin Endocrinol Metab. 2019 May 1;104(5):1753-1765. doi: 10.1210/jc.2018-02236. PMID: 30535289; PMCID: PMC6447951.). Im Kurzzeitvergleich (365 Tage) zeigten Denosumab und Zoledronat keine Unterschiede in Wirksamkeit (Frakturinzidenz) und Sicherheit (bezüglich Infektion und kardiovaskuläre Nebenwirkungen) (Choi NK et al. 2017 📖Choi NK, Solomon DH, Tsacogianis TN, Landon JE, Song HJ, Kim SC. Comparative Safety and Effectiveness of Denosumab Versus Zoledronic Acid in Patients With Osteoporosis: A Cohort Study. J Bone Miner Res. 2017 Mar;32(3):611-617. doi: 10.1002/jbmr.3019. Epub 2017 Feb 7. PMID: 27736041; PMCID: PMC5340628.). In einem systematischen Review mit Metaanalyse zeigte Denosumab eine signifikant stärkere Wirksamkeit auf die Knochendichte bei gleichem Nebenwirkungsprofil im Vergleich zu alternativen Medikamenten (Ibandronat, Risedronat, Alendronat, Zoledronat, Teriparatid). Bezüglich Frakturen zeigte sich jedoch kein Unterschied. Die sechs betrachteten Einzelstudien waren aber auch nicht auf Fraktur-Outcomes gepowert. (Fontalis A et al. 2018 📖Fontalis A, Kenanidis E, Prousali E, Potoupnis M, Tsiridis E. Safety and efficacy of denosumab in osteoporotic patients previously treated with other medications: a systematic review and meta-analysis. Expert Opin Drug Saf. 2018 Apr;17(4):413-428. doi: 10.1080/14740338.2018.1430764. Epub 2018 Jan 25. PMID: 29350565.).
Es gibt mehrere Studien, die bei postmenopausalen Frauen eine stärkere Zunahme der Knochendichte bei einer Kombination aus zwei Präparaten im Vergleich zu den Veränderungen der Knochendichte bei einer Einzeltherapie berichten. Eine Kombination von Teriparatid mit Zoledronat führte signifikant schneller zum Knochendichte-Anstieg als die jeweilige Monotherapie, dies bei Annäherung der Ergebnisse nach 12 Monaten (Cosman F et al. 2011 📖Cosman F, Eriksen EF, Recknor C, Miller PD, Guañabens N, Kasperk C, Papanastasiou P, Readie A, Rao H, Gasser JA, Bucci-Rechtweg C, Boonen S. Effects of intravenous zoledronic acid plus subcutaneous teriparatide [rhPTH(1-34)] in postmenopausal osteoporosis. J Bone Miner Res. 2011 Mar;26(3):503-11. doi: 10.1002/jbmr.238. PMID: 20814967.). Trotz kurzer Beobachtungszeit und kleiner Gruppen war die Anzahl an Gesamtfrakturen nach 12 Monaten unter der Kombinationstherapie signifikant geringer als unter Zoledronat alleine. Eine Kombination aus einer bestehenden Hormonersatztherapie und Teriparatid zeigt ebenfalls einen stärkeren Knochendichtezuwachs (Ste-Marie LG et al. 📖Ste-Marie LG, Schwartz SL, Hossain A, Desaiah D, Gaich GA. Effect of teriparatide [rhPTH(1-34)] on BMD when given to postmenopausal women receiving hormone replacement therapy. J Bone Miner Res. 2006 Feb;21(2):283-91. doi: 10.1359/JBMR.051020. Epub 2005 Oct 31. PMID: 16418784. 2006 SIGN 1-.). Für die Kombination aus Denosumab plus Teriparatid liegen signifikante synergistische Ergebnisse aus einer prospektiv randomisierten Studie hinsichtlich Knochendichtezunahme (Leder BZ et al. 2014 📖Leder BZ, Tsai JN, Uihlein AV, Burnett-Bowie SA, Zhu Y, Foley K, Lee H, Neer RM. Two years of Denosumab and teriparatide administration in postmenopausal women with osteoporosis (The DATA Extension Study): a randomized controlled trial. J Clin Endocrinol Metab. 2014 May;99(5):1694-700. doi: 10.1210/jc.2013-4440. Epub 2014 Feb 11. PMID: 24517156; PMCID: PMC4010689., Tsai JN et al. 2013 📖Tsai JN, Uihlein AV, Lee H, Kumbhani R, Siwila-Sackman E, McKay EA, Burnett-Bowie SA, Neer RM, Leder BZ. Teriparatide and denosumab, alone or combined, in women with postmenopausal osteoporosis: the DATA study randomised trial. Lancet. 2013 Jul 6;382(9886):50-6. doi: 10.1016/S0140-6736(13)60856-9. Epub 2013 May 15. PMID: 23683600; PMCID: PMC4083737. 1++ SIGN für Knochendichte) bei fehlenden Frakturendpunktdaten vor. Romosozumab hat einen dualen, also antiresorptiven und osteoanabolen, Wirkmechanismus. Romosozumab ist, gemessen am Surrogatparameter Knochendichte, noch wirksamer als die Kombinationstherapien (McClung MR et al. 2018 📖McClung MR. Romosozumab for the treatment of osteoporosis. Osteoporos Sarcopenia. 2018 Mar;4(1):11-15. doi: 10.1016/j.afos.2018.03.002. Epub 2018 Mar 27. PMID: 30775535; PMCID: PMC6362945.).
| Empfehlung | |
|
Falls bei sehr hohem imminenten Frakturrisiko (vgl. Kapitel 9.5.3.1.) Romosozumab nicht zum Einsatz kommen kann (Bsp. Kontraindikation, Unverträglichkeit), dann kann eine kurzzeitige Kombinationstherapie aus Teriparatid und parenteralem Antiresorptivum im Einzelfall erwogen werden.
|
Empfehlungsgrad 0 |
| Evidenzgrad 2 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenzen:
Cosman F, Eriksen EF, Recknor C, Miller PD, Guañabens N, Kasperk C, Papanastasiou P, Readie A, Rao H, Gasser JA, Bucci-Rechtweg C, Boonen S. Effects of intravenous zoledronic acid plus subcutaneous teriparatide [rhPTH(1-34)] in postmenopausal osteoporosis. J Bone Miner Res. 2011 Mar;26(3):503-11. doi: 10.1002/jbmr.238. PMID: 20814967. LoE2 Tsai JN, Uihlein AV, Lee H, Kumbhani R, Siwila-Sackman E, McKay EA, Burnett-Bowie SA, Neer RM, Leder BZ. Teriparatide and denosumab, alone or combined, in women with postmenopausal osteoporosis: the DATA study randomised trial. Lancet. 2013 Jul 6;382(9886):50-6. doi: 10.1016/S0140-6736(13)60856-9. Epub 2013 May 15. PMID: 23683600; PMCID: PMC4083737. 1++ SIGN für Knochendichte |
|
Eine spezielle Konstellation ergibt sich für Frauen, die mit einer niedrig dosierten Hormontherapie wegen postmenopausaler Beschwerden behandelt werden. Eine unterhalb der osteologisch wirksamen Standarddosierung verabreichte Hormontherapie hat keine volle Wirksamkeit auf den Knochenstoffwechsel. Deswegen ist eine Kombination mit einem spezifischen Osteoporose-Präparat vertretbar.
| Empfehlung | |
|
Wenn bei Frauen eine Hormontherapie unterhalb der Standarddosierung erfolgt, kann bei gleichzeitigem Vorliegen einer medikamentös behandlungsbedürftigen Osteoporose erwogen werden, diese mit einem spezifischen Osteoporose-Präparat zu kombinieren.
|
Empfehlungsgrad 0 |
| Evidenzgrad 4 |
|
| Konsensstärke 17/17 Starker Konsens |
|
Es wird auch auf Kapitel 9.5.4. verwiesen. Insgesamt ist die Therapieadhärenz nur mit individueller, personalisierter Medizin zu verbessern. Ein aktueller systematischer Review (Cornelissen D et al. 2020 📖Cornelissen D, de Kunder S, Si L, Reginster JY, Evers S, Boonen A, Hiligsmann M; European Society for Clinical and Economic Aspect of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Interventions to improve adherence to anti-osteoporosis medications: an updated systematic review. Osteoporos Int. 2020 Sep;31(9):1645-1669. doi: 10.1007/s00198-020-05378-0. Epub 2020 May 1. PMID: 32358684; PMCID: PMC7423788.) deutet darauf hin, dass Patientenschulung, Überwachung und Kontrolle, Änderung des Medikamentenregimes und interdisziplinäre Zusammenarbeit gemischte Ergebnisse in Bezug auf die Medikamentenadhärenz und -persistenz haben, mit positiveren Auswirkungen für Multikomponenten-Interventionen mit aktiver Patientenbeteiligung. Es wurde eine Verschiebung hin zu mehr Patientenbeteiligung, Beratung und gemeinsamer Entscheidungsfindung festgestellt, was darauf hindeutet, dass individuelle Lösungen auf der Grundlage der Zusammenarbeit zwischen Patientinnen und Patienten und Gesundheitsdienstleistern (Ärztin/Arzt) erforderlich sind, um die Adhärenz und Persistenz von Osteoporose-Medikation zu verbessern (Hilligsmann M et al. 2013 LoE 2+ 📖Hiligsmann M, Salas M, Hughes DA, Manias E, Gwadry-Sridhar FH, Linck P, Cowell W. Interventions to improve osteoporosis medication adherence and persistence: a systematic review and literature appraisal by the ISPOR Medication Adherence & Persistence Special Interest Group. Osteoporos Int. 2013 Dec;24(12):2907-18. doi: 10.1007/s00198-013-2364-z. Epub 2013 May 1. PMID: 23636230. LoE 2+).
| Empfehlung | |
|
Es sollten individuelle Lösungen auf der Grundlage der Zusammenarbeit zwischen Patientin/Patient und Ärztin/Arzt zur Verbesserung der Therapieadhärenz gesucht werden.
|
Empfehlungsgrad B |
| Evidenzgrad 2 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenzen:
Hiligsmann M, Salas M, Hughes DA, Manias E, Gwadry-Sridhar FH, Linck P, Cowell W. Interventions to improve osteoporosis medication adherence and persistence: a systematic review and literature appraisal by the ISPOR Medication Adherence & Persistence Special Interest Group. Osteoporos Int. 2013 Dec;24(12):2907-18. doi: 10.1007/s00198-013-2364-z. Epub 2013 May 1. PMID: 23636230. LoE 2+ Cornelissen D, de Kunder S, Si L, Reginster JY, Evers S, Boonen A, Hiligsmann M; European Society for Clinical and Economic Aspect of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Interventions to improve adherence to anti-osteoporosis medications: an updated systematic review. Osteoporos Int. 2020 Sep;31(9):1645-1669. doi: 10.1007/s00198-020-05378-0. Epub 2020 May 1. PMID: 32358684; PMCID: PMC7423788. LoE 1 |
|
Die Adhärenz ist bei intravenöser Bisphosphonat-Therapie und Denosumab-Therapie höher als bei oraler Therapie (Hadji P et al. 2014 📖Hadji P, Felsenberg D, Amling M, Hofbauer LC, Kandenwein JA, Kurth A. The non-interventional BonViva Intravenous Versus Alendronate (VIVA) study: real-world adherence and persistence to medication, efficacy, and safety, in patients with postmenopausal osteoporosis. Osteoporos Int. 2014 Jan;25(1):339-47. doi: 10.1007/s00198-013-2515-2. Epub 2013 Oct 3. PMID: 24091594., Hadji P et al. 2015 📖Hadji P, Papaioannou N, Gielen E, Feudjo Tepie M, Zhang E, Frieling I, Geusens P, Makras P, Resch H, Möller G, Kalouche-Khalil L, Fahrleitner-Pammer A. Persistence, adherence, and medication-taking behavior in women with postmenopausal osteoporosis receiving denosumab in routine practice in Germany, Austria, Greece, and Belgium: 12-month results from a European non-interventional study. Osteoporos Int. 2015 Oct;26(10):2479-89. doi: 10.1007/s00198-015-3164-4. Epub 2015 May 28. PMID: 26018090; PMCID: PMC4575374., Karlsson L et al. 2015 📖Karlsson L, Lundkvist J, Psachoulia E, Intorcia M, Ström O. Persistence with denosumab and persistence with oral bisphosphonates for the treatment of postmenopausal osteoporosis: a retrospective, observational study, and a meta-analysis. Osteoporos Int. 2015 Oct;26(10):2401-11. doi: 10.1007/s00198-015-3253-4. Epub 2015 Aug 18. PMID: 26282229; PMCID: PMC4575381.). Zudem ist die Adhärenz besser bei Patientinnen und Patienten mit hoher Gesundheitskompetenz (health literacy) (Roh YH et al. 2018 📖Roh YH, Noh JH, Gong HS, Baek GH. Comparative adherence to weekly oral and quarterly intravenous bisphosphonates among patients with limited heath literacy who sustained distal radius fractures. J Bone Miner Metab. 2018 Sep;36(5):589-595. doi: 10.1007/s00774-017-0867-y. Epub 2017 Oct 5. PMID: 28983705. LoE 2).
| Empfehlung | |
|
Bei individuellen Gegebenheiten mit bestehenden oder zu erwartenden Problemen mit der oralen Applikationsform kann erwogen werden, den parenteralen Therapieansätzen gegenüber oralen den Vorzug zu geben.
|
Empfehlungsgrad 0 |
| Evidenzgrad 2 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenzen:
Hadji P, Felsenberg D, Amling M, Hofbauer LC, Kandenwein JA, Kurth A. The non-interventional BonViva Intravenous Versus Alendronate (VIVA) study: real-world adherence and persistence to medication, efficacy, and safety, in patients with postmenopausal osteoporosis. Osteoporos Int. 2014 Jan;25(1):339-47. doi: 10.1007/s00198-013-2515-2. Epub 2013 Oct 3. PMID: 24091594. LoE 3 Hadji P, Papaioannou N, Gielen E, Feudjo Tepie M, Zhang E, Frieling I, Geusens P, Makras P, Resch H, Möller G, Kalouche-Khalil L, Fahrleitner-Pammer A. Persistence, adherence, and medication-taking behavior in women with postmenopausal osteoporosis receiving denosumab in routine practice in Germany, Austria, Greece, and Belgium: 12-month results from a European non-interventional study. Osteoporos Int. 2015 Oct;26(10):2479-89. doi: 10.1007/s00198-015-3164-4. Epub 2015 May 28. PMID: 26018090; PMCID: PMC4575374. LoE 3 Karlsson L, Lundkvist J, Psachoulia E, Intorcia M, Ström O. Persistence with denosumab and persistence with oral bisphosphonates for the treatment of postmenopausal osteoporosis: a retrospective, observational study, and a meta-analysis. Osteoporos Int. 2015 Oct;26(10):2401-11. doi: 10.1007/s00198-015-3253-4. Epub 2015 Aug 18. PMID: 26282229; PMCID: PMC4575381. LoE3 Roh YH, Noh JH, Gong HS, Baek GH. Comparative adherence to weekly oral and quarterly intravenous bisphosphonates among patients with limited heath literacy who sustained distal radius fractures. J Bone Miner Metab. 2018 Sep;36(5):589-595. doi: 10.1007/s00774-017-0867-y. Epub 2017 Oct 5. PMID: 28983705. LoE 2 |
|
Für die patientenindividuelle Medikamentenauswahl sind die aktuell gültigen Fachinformationen der Präparate zu beachten. Im Folgenden werden – ohne Anspruch auf Vollständigkeit – Beratungsthemen aufgegriffen, die aus Expertenmeinung häufig und praxisrelevant sind.
Atypische subtrochantäre und diaphysäre Femurfrakturen wurden unter einer Bisphosphonat-Therapie vor allem bei Patientinnen und Patienten unter Langzeitbehandlung einer Osteoporose berichtet. Es handelt sich um eine seltene Nebenwirkung, die nach SIGN mit einem Vorkommen von 6-30/10.000 Patientenjahren zu beziffern ist. Auch unter einer Therapie mit Denosumab wurden atypische Femurfrakturen beobachtet. Das Risiko ist von der Dauer der Therapie abhängig und nimmt nach Absetzen der Therapie im Verlauf wieder deutlich ab (Black DM et al. 2020 📖Black DM, Geiger EJ, Eastell R, Vittinghoff E, Li BH, Ryan DS, Dell RM, Adams AL. Atypical Femur Fracture Risk versus Fragility Fracture Prevention with Bisphosphonates. N Engl J Med. 2020 Aug 20;383(8):743-753. doi: 10.1056/NEJMoa1916525. PMID: 32813950.). Aufgrund der Seltenheit dieser Ereignisse ist das Risiko für osteoporotische Frakturen auch nach langjähriger Therapie aufgrund der risiko-adaptierten Therapieindikation immer höher als das Risiko für atypische Frakturen. Für die individuelle Suszeptibilität vermutet man genetische Komponenten, eindeutige Assoziationen gibt es aber bisher nur mit der Hypophosphatasie (HPP). Milde Formen der HPP sollten im Zweifelsfall ausgeschlossen werden (s. Kapitel Basisdiagnostik, Basislabor), um falsche Pfade im therapeutischen Management zu vermeiden (Zhou W et al. 2021 📖Zhou W, van Rooij JGJ, Ebeling PR, Verkerk AJMH, Zillikens MC. The Genetics of Atypical Femur Fractures-a Systematic Review. Curr Osteoporos Rep. 2021 Apr;19(2):123-130. doi: 10.1007/s11914-021-00658-y. Epub 2021 Feb 15. PMID: 33587247; PMCID: PMC8016774.; Peris P et al. 2018 📖Peris P, González-Roca E, Rodríguez-García SC, Del Mar López-Cobo M, Monegal A, Guañabens N. Incidence of Mutations in the ALPL, GGPS1, and CYP1A1 Genes in Patients With Atypical Femoral Fractures. JBMR Plus. 2018 Jun 22;3(1):29-36. doi: 10.1002/jbm4.10064. PMID: 30680361; PMCID: PMC6339546.).
Die Antiresorptiva-assoziierte Kiefernekrose (AR-ONJ) bei Osteoporose-Patientinnen und -Patienten ist eine seltene Therapiefolge. In der interdisziplinär konsentierten AWMF S3-Leitlinie „Antiresorptiva-assoziierte Kiefernekrose“ (AR-ONJ, AWMF-Register-Nr. 007-091) wird dem Kollektiv der primären Osteoporose das niedrigste AR-ONJ Risikoprofil zugeordnet. Trotz geringer Ereignisrate hat sich die AR-ONJ in den letzten Jahren zu einer ernst zu nehmenden Nebenwirkung entwickelt. Die Aufklärung der Patientinnen und Patienten, vorbeugende Maßnahmen und eine frühzeitige Therapie sind entscheidend, um das Risiko für die Manifestation der Erkrankung zu minimieren, sowie knöcherne Defekte und Minderung an Lebensqualität zu vermeiden. Vor allem den vorbeugenden Maßnahmen kommt hierbei eine große Bedeutung zu.
Die oben genannte AWMF S3-Leitlinie dient hierfür als evidenzbasierter Leitfaden. Bezugnehmend auf die Infektionsabhängigkeit in der Pathogenese der AR-ONJ leiten sich hierbei sämtliche vorbeugenden und therapeutischen Maßnahmen zur Vermeidung und Entfernung von Weichgewebs- und/oder dentalen Infektionen am Kiefer ab (Leitlinie AR-ONJ, AWMF-Register-Nr. 007-091).
Vor Beginn der antiresorptiven oder Romosozumab-Therapie sollen die Patientinnen und Patienten über das Risiko einer AR-ONJ (inklusive Einschätzung des Risikoprofils anhand Medikation und Begleitfaktoren) unterrichtet werden. Aufgrund des AR-ONJ Risikos soll der oder die AR-Verordnende eine Vorstellung beim Hauszahnarzt oder -ärztin anregen. Diesen kommt eine Schlüsselrolle zu, da sie prophylaktische Maßnahmen durchführen können und ggf. zur spezialisierten Versorgungsebene (MKG-Chirurgie, Oralchirurgie, Parodontologie) überweisen.
Mit Beginn einer Therapie mit antiresorptiven Medikamenten oder Romosozumab soll eine Fokussuche, Anpassung von Zahnersatz zur Vermeidung von Druckstellen und eine Sanierung von Infektionen und Bakterieneintrittspforten im Mund-Kiefer-Bereich begonnen werden. Insgesamt umfasst die Sanierung des Zahnstatus bzw. der Mundhöhle Maßnahmen, die auch ohne die o. g. Medikationen sinnvoll und medizinisch notwendig sind, hier aber zur Risikominderung einer AR-ONJ dienen und deshalb von hoher Bedeutung sind. Es empfiehlt sich eine rechtzeitige interdisziplinäre Abstimmung, um das Risiko der Entstehung einer AR-ONJ gemeinsam zu minimieren. Der Beginn einer Osteoporose-Therapie soll wegen der niedrigen AR-ONJ-Ereignisrate durch die vorbeugenden Maßnahmen nicht hinausgezögert werden. Herausforderung hierbei ist es, die diagnostischen und therapeutischen Maßnahmen vor allem patientenspezifisch und risikoadaptiert abzuwägen. Zur Verbesserung und Vereinfachung der interdisziplinären Kommunikation dient der konsentierte und in der o. g. S3-Leitlinie empfohlene AGSMO-Laufzettel (Leitlinie AR-ONJ, AWMF-Register-Nr. 007-091).
Mit Beginn der antiresorptiven oder Rosmosozumab-Therapie und nach erfolgter Fokussanierung soll dann jede Patientin und jeder Patient in ein risikoadaptiertes Recall-Programm eingegliedert werden, das bei Osteoporose-Betroffenen eine Wiedervorstellung mindestens alle 12 Monate vorsieht. Unter laufender oder nach stattgehabter antiresorptiver Therapie soll bei Verdacht auf einen dentalen Fokus die Überweisung zur Zahnärztin/zu Zahnarzt oder Spezialistin/Spezialist und bei Verdacht auf eine AR-ONJ zur Mund-, Kiefer- Gesichtschirurgin/Kieferchirurgen erfolgen.
Für weitere Details sei auf die Langfassung der AR-ONJ-Leitlinie verwiesen (Leitlinie AR-ONJ, AWMF-Register-Nr. 007-091).
| Empfehlung | |
|
Mit Beginn einer Therapie mit Bisphosphonaten, Denosumab oder Romosozumab soll eine zahnärztliche Vorstellung empfohlen werden. Der Beginn der Osteoporose-Therapie soll wegen der niedrigen AR-ONJ-Ereignisrate durch eine zahnärztliche ONJ-Prophylaxe nicht hinausgezögert werden.
Anschließend soll den Patientinnen und Patienten die Eingliederung in ein zahnärztliches risikoadaptiertes Recall-Programm empfohlen werden. |
Empfehlungsgrad A |
| Evidenzgrad 1 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz:
S3-Leitlinie Antiresorptiva-assoziierte Kiefernekrose (AR-ONJ) AWMF Registernummer 007 – 091. |
|
Bei der Anwendung von Denosumab in Osteoporose-Dosierung und bei Bisphosphonaten in Osteoporose Dosierung sind seltene Fälle schwerer Hypokalzämien bei Patientinnen und Patienten mit einer Neigung zu Hypokalzämien beschrieben. Eine Hypokalzämie ist bei der Anwendung von Bisphosphonaten und Denosumab und einer Therapie mit Romosozumab eine Kontraindikation. Vor allem bei einer Anwendung von parenteralen Antiresorptiva ist vor einer Anwendung eine tägliche Gesamtzufuhr von mindestens 1.000 mg Calcium und eine ausreichende Versorgung mit Vitamin D, ggf. durch eine adäquate Vortherapie mit Calcium und Vitamin D, sicherzustellen.
Für keines der zugelassenen Präparate konnte in den Zulassungsstudien ein erhöhtes Malignomrisiko festgestellt werden.
In einer Oxford-Metaanalyse der EBCTCG (EBCTCG 2015 📖Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Adjuvant bisphosphonate treatment in early breast cancer: meta-analyses of individual patient data from randomised trials. Lancet. 2015 Oct 3;386(10001):1353-1361. doi: 10.1016/S0140-6736(15)60908-4. Epub 2015 Jul 23. Erratum in: Lancet. 2016 Jan 2;387(10013):30. Erratum in: Lancet. 2017 Jun 24;389(10088):2472. PMID: 26211824.) hat sich bei einer Anwendung von Bisphosphonaten bei postmenopausalen Frauen mit Hormonrezeptor-positivem Mammakarzinom unter einer Therapie mit Aromataseinhibitoren oder GnRH +/- Tamoxifen/Aromataseinhibitor ohne Knochenmetastasen eine signifikante, 34%ige Risikoreduktion für das Auftreten von Knochenmetastasen sowie eine 17%ige Risikoreduktion der brustkrebsspezifischen Mortalität gezeigt. Allerdings sind diese Präparate nur bei Osteoporose oder metastasierenden Mammakarzinomen zugelassen, sodass ihr Einsatz außerhalb dieses Bereiches eine “off-label-Therapie” darstellt. In einer Studie mit Zoledronat zur Frakturprävention konnte gezeigt werden, dass das Krebsrisiko in der Behandlungsgruppe deutlich reduziert wurde (hazard ratio 0,67, signifikant für Brustkrebs und Nicht-Brustkrebs-Fälle). Die Ergebnisse dieser Studie bestätigen Ergebnisse einer früheren Untersuchung mit primärem Endpunkt „osteoporotische Frakturen“ (Reid IR et al. 2020 📖Reid IR, Horne AM, Mihov B, Stewart A, Garratt E, Bastin S, Gamble GD. Effects of Zoledronate on Cancer, Cardiac Events, and Mortality in Osteopenic Older Women. J Bone Miner Res. 2020 Jan;35(1):20-27. doi: 10.1002/jbmr.3860. Epub 2019 Oct 11. PMID: 31603996.), die eine Reduktion der Mortalität bei Gabe nach proximaler Femurfraktur zeigte.
Raloxifen (relatives Risiko 0,44 (95 % KI 0,27-0,7) reduziert das Risiko eines invasiven Hormonrezeptor-positiven Mammakarzinoms, verglichen mit Placebo (Cummings SR et al. 1999 📖Cummings SR, Eckert S, Krueger KA, Grady D, Powles TJ, Cauley JA, Norton L, Nickelsen T, Bjarnason NH, Morrow M, Lippman ME, Black D, Glusman JE, Costa A, Jordan VC. The effect of raloxifene on risk of breast cancer in postmenopausal women: results from the MORE randomized trial. Multiple Outcomes of Raloxifene Evaluation. JAMA. 1999 Jun 16;281(23):2189-97. doi: 10.1001/jama.281.23.2189. Erratum in: JAMA 1999 Dec 8;282(22):2124. PMID: 10376571.). In der MORE-Studie (Multiple Outcome Raloxifene Evaluation) betrug diese Risikosenkung 90 % (RR, 0,10; 95 % CI, 0,04-0,24), nicht aber für Östrogenrezeptor-negative Mammakarzinome.
In der Fachinformation von Teriparatid wird darauf hingewiesen, dass bei Ratten, die fast über ihre gesamte Lebenszeit mit täglichen Teriparatid-Injektionen behandelt wurden, eine übersteigerte Knochenbildung und eine erhöhte Inzidenz von Osteosarkomen beobachtet worden war. Teriparatid erhöhte bei Ratten nicht die Inzidenz anderer Tumor-Entitäten. Weder in klinischen Studien noch während der post-therapeutischen Beobachtungsstudie wurden Osteosarkome bei Menschen beobachtet. 2021 wurde eine Auswertung der Forteo Patient Registry veröffentlicht (Gilsenan A, Harris D et al. 2021 📖Gilsenan A, Midkiff K, Harris D, Kellier-Steele N, McSorley D, Andrews EB. Teriparatide Did Not Increase Adult Osteosarcoma Incidence in a 15-Year US Postmarketing Surveillance Study. J Bone Miner Res. 2021 Feb;36(2):244-251. doi: 10.1002/jbmr.4188. Epub 2020 Oct 13. PMID: 32990990; PMCID: PMC7988650.). Es wurden Daten von 75.247 Patientinnen und Patienten, entsprechend 361.763 kumulativen Personenjahren, aus den Jahren 2009-2019 analysiert und mit 42 Krebsregistern aus den Jahren 2010-2019 abgeglichen (entsprechend 93 % US-Bevölkerung), die 6.180 Osteosarkompatientinnen und -patienten beinhalteten. Hierunter fand sich kein einziger Fall aus dem Forteo-Register. Die Aussagefähigkeit der Studie ist dadurch eingeschränkt, dass die Hintergrundinzidenz von Osteosarkomen nur bei 3/1.000.000 liegt. Auch andere aktuelle Publikationen bestätigen diese Einschätzung (Gilsenan A et al. 2020 📖Gilsenan A, Midkiff K, Harris D, McQuay L, Hunter S, Kellier-Steele N, Andrews E. Assessing the incidence of osteosarcoma among teriparatide users based on Medicare Part D and US State Cancer Registry Data. Pharmacoepidemiol Drug Saf. 2020 Dec;29(12):1616-1626. doi: 10.1002/pds.5103. Epub 2020 Sep 7. PMID: 32894794; PMCID: PMC7754479.; Gilsenan A, Midkiff K et al. 2021 📖Gilsenan A, Midkiff K, Harris D, McQuay L, Hunter S, Kellier-Steele N, Andrews E. Assessing the incidence of osteosarcoma among teriparatide users based on Medicare Part D and US State Cancer Registry Data. Pharmacoepidemiol Drug Saf. 2020 Dec;29(12):1616-1626. doi: 10.1002/pds.5103. Epub 2020 Sep 7. PMID: 32894794; PMCID: PMC7754479.).
In einer epidemiologischen retrospektiven Kohortenstudie unter Verwendung der “United Kingdom’s General Practice Research Database” war eine Einnahme von Bisphosphonaten bei Patientinnen und Patienten mit einer Knie- oder Hüftprothese mit einer fast 2-fach längeren Überlebensrate der Prothese als bei Betroffenen ohne eine Bisphosphonateinnahme assoziiert (Prieto-Alhambra D et al. 2011 📖Khalid S, Calderon-Larrañaga S, Hawley S, Ali MS, Judge A, Arden N, van Staa T, Cooper C, Javaid MK, Prieto-Alhambra D. Comparative anti-fracture effectiveness of different oral anti-osteoporosis therapies based on “real-world” data: a meta-analysis of propensity-matched cohort findings from the UK Clinical Practice Research Database and the Catalan SIDIAP Database. Clin Epidemiol. 2018 Oct 9;10:1417-1431. doi: 10.2147/CLEP.S164112. PMID: 30349390; PMCID: PMC6183551.). Bisphosphonate sind nicht kontraindiziert und nicht zu pausieren aufgrund einer TEP. Umgekehrt kann aus dieser Studie auch keine Empfehlung zum Einsatz von Bisphosphonaten bei Implantationen einer Endoprothese abgeleitet werden.
Das Risiko venöser thromboembolischer Ereignisse einschließlich tiefer Venenthrombosen, Lungenembolien und Retina-Venenthrombosen ist bei Raloxifen und Bazedoxifen erhöht (Vestergaard P et al. 2011 📖Vestergaard P, Schwartz K, Pinholt EM, Rejnmark L, Mosekilde L. Stroke in relation to use of raloxifene and other drugs against osteoporosis. Osteoporos Int. 2011 Apr;22(4):1037-45. doi: 10.1007/s00198-010-1276-4. Epub 2010 May 7. PMID: 20449570.). Es handelt sich um eine gelegentliche Nebenwirkung. In einer Studie mit postmenopausalen Frauen mit manifester koronarer Herzerkrankung (KHE) oder dokumentierten Risikofaktoren für eine KHE zeigte sich kein signifikanter Unterschied in Bezug auf die Gesamtmortalität oder die Schlaganfall-assoziierte Mortalität, aber Raloxifen war mit einem erhöhten Risiko für tödliche apoplektische Insulte assoziiert (absolute Risikoerhöhung 0,7/1000 Jahre für 1 Jahr Therapie).
Unter einer Bisphosphonat-Therapie wurde eine vermehrte Häufigkeit von Vorhofflimmern beschrieben. Daten hierzu variieren unter den verschiedenen Bisphosphonaten und zwischen den verschiedenen Studien. Eine Kausalität zur Bisphosphonat-Einnahme konnte in den bisherigen Studien nicht klar belegt werden. Ein Zusammenhang zwischen der Einnahme von Bisphosphonaten und einer höheren Inzidenz von Vorhofflimmern kann aber nicht sicher ausgeschlossen werden. In den großen randomisierten Studien zeigte sich für Myokardinfarkt und Schlaganfall eher ein protektiver Effekt für Bisphosphonate (Rodríguez AJ et al. 2021 📖Rodríguez AJ, Abrahamsen B. Cardiovascular Safety of Antifracture Medications in Patients With Osteoporosis: A Narrative Review of Evidence From Randomized Studies. JBMR Plus. 2021 Jun 23;5(7):e10522. doi: 10.1002/jbm4.10522. Erratum in: JBMR Plus. 2022 May 11;6(6):e10628. PMID: 34258509; PMCID: PMC8260817.) mit einem relativen Risiko von 0,58-0,96 bzw. 0,90-0,99. Für Denosumab und Teriparatid ergaben sich keine Hinweise auf ein erhöhtes kardiovaskuläres Risiko (Rodríguez AJ et al. 2021 📖Rodríguez AJ, Abrahamsen B. Cardiovascular Safety of Antifracture Medications in Patients With Osteoporosis: A Narrative Review of Evidence From Randomized Studies. JBMR Plus. 2021 Jun 23;5(7):e10522. doi: 10.1002/jbm4.10522. Erratum in: JBMR Plus. 2022 May 11;6(6):e10628. PMID: 34258509; PMCID: PMC8260817.).
Für Romosozumab liegen aus den Zulassungsstudien geringfügige Hinweise für eine erhöhte Inzidenz zerebrovaskulärer Nebenwirkungen vor, die im Zulassungstext der EMA zu einem Warnhinweis geführt haben. In der FRAME-Studie (Durchschnittsalter 71 Jahre) zeigten sich bei Studienende (24 Monate) in der Romosozumab/Denosumab-Gruppe 2,3 % vaskuläre Ereignisse, davon 1,0 % ischämische Herzereignisse und 1,3 % zerebrovaskuläre Ereignisse, verglichen mit 2,2 % in der Placebo/Denosumab-Gruppe (Cosman F et al. 2018 📖Cosman F, Crittenden DB, Ferrari S, Khan A, Lane NE, Lippuner K, Matsumoto T, Milmont CE, Libanati C, Grauer A. FRAME Study: The Foundation Effect of Building Bone With 1 Year of Romosozumab Leads to Continued Lower Fracture Risk After Transition to Denosumab. J Bone Miner Res. 2018 Jul;33(7):1219-1226. doi: 10.1002/jbmr.3427. Epub 2018 May 17. PMID: 29573473.). In der Verlängerungsstudie zeigten sich nach 36 Monaten 3,6 % schwere vaskuläre Ereignisse in der Romosozumab/Denosumab-Gruppe, 3,5 % in der Placebo-/Denosumab-Gruppe (Lewiecki EM et al. 2018 📖Lewiecki EM, Dinavahi RV, Lazaretti-Castro M, Ebeling PR, Adachi JD, Miyauchi A, Gielen E, Milmont CE, Libanati C, Grauer A. One Year of Romosozumab Followed by Two Years of Denosumab Maintains Fracture Risk Reductions: Results of the FRAME Extension Study. J Bone Miner Res. 2019 Mar;34(3):419-428. doi: 10.1002/jbmr.3622. Epub 2018 Dec 3. PMID: 30508316.). In der ARCH-Studie (Durchschnittsalter 74 Jahre) zeigten sich bei Studienende (36 Monate) in der Alendronat/Alendronat-Gruppe 6,1 % schwere vaskuläre Ereignisse, beinhaltend 1,0 % ischämische Herzereignisse und 1,3 % zerebrovaskuläre Ereignisse, verglichen mit 6,5 %, 1,5 % und 2,2 % in der Romosozumab/Alendronat-Gruppe (Cosman F et al. 2017 📖Cosman F, Crittenden DB, Ferrari S, Khan A, Lane NE, Lippuner K, Matsumoto T, Milmont CE, Libanati C, Grauer A. FRAME Study: The Foundation Effect of Building Bone With 1 Year of Romosozumab Leads to Continued Lower Fracture Risk After Transition to Denosumab. J Bone Miner Res. 2018 Jul;33(7):1219-1226. doi: 10.1002/jbmr.3427. Epub 2018 May 17. PMID: 29573473.). Ein systematisches Review und Metaanalyse bestätigt die kardiovaskuläre Unbedenklichkeit von Denosumab und die uneindeutige Datenlage für Romosozumab (Lv F et al. 2020 📖Lv F, Cai X, Yang W, Gao L, Chen L, Wu J, Ji L. Denosumab or romosozumab therapy and risk of cardiovascular events in patients with primary osteoporosis: Systematic review and meta- analysis. Bone. 2020 Jan;130:115121. doi: 10.1016/j.bone.2019.115121. Epub 2019 Oct 31. PMID: 31678488.). Bei Romosozumab kam es zu einem nicht signifikanten Anstieg des Risikos für den kombinierten kardiovaskulären Endpunkt und den sog. 3P-MACE (3 Punkt-Endpunkt für schwere vaskuläre Ereignisse: kardiovaskulärer Tod, nicht-tödlicher Myokardinfarkt, nicht-tödlicher Herzinfarkt), jedoch zu einem signifikanten Anstieg der 4P-MACE (inklusive instabile Angina pectoris) mit einem relativen Risiko von 1,39 (p=0,04).
Zusammenfassend müssen individuelles kardiovaskuläres Risiko und (Zusatz-) Nutzen einer Romosozumab-Therapie miteinander abgewogen werden. Für Patientinnen und Patienten mit Schlaganfall oder Herzinfarkt in der Eigenanamnese besteht eine Kontraindikation.
Bereits in der prospektiven Zulassungsstudie für Denosumab fiel bei der Analyse der Nebenwirkungen auf, dass in der Verumgruppe 21% weniger Stürze (ohne Folge einer Fraktur) auftraten als in der Plazebogruppe (4,5% versus 5,7%, p=0,02, in absoluten Zahlen n= 175/219) (Cummings SR et al. 2009 📖Cummings SR, San Martin J, McClung MR et al.; FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009 Aug 20;361(8):756-65. doi: 10.1056/NEJMoa0809493. Epub 2009 Aug 11. Erratum in: N Engl J Med. 2009 Nov 5;361(19):1914. PMID: 19671655.). In einer Metaanalyse von insgesamt 5 prospektiven Studien konnte diese 21%ige Sturzrisikoreduktion gegenüber Plazebo bestätigt werden (Chotiyarnwong P, et al. 2020 📖Chotiyarnwong P, et al. Journal of Bone and Mineral Research, Vol. 35, No. 6, June 2020, pp 1014–1021). In einer prospektiven, multizentrischen, kontrollierten Studie (Miedany YE et al. 2021 📖Miedany YE, Gaafary ME, Toth M et al. Egyptian Academy of Bone Health, Metabolic Bone Diseases. Is there a potential dual effect of denosumab for treatment of osteoporosis and sarcopenia? Clin Rheumatol. 2021 Oct;40(10):4225-4232. doi: 10.1007/s10067-021-05757-w. Epub 2021 May 19. PMID: 34008069.) wurde ohne Randomisierung die Behandlung von Denosumab mit den Bisphosphonaten Alendronat und Zoledronat bzgl. muskulärer Endpunkte untersucht. Nach 5 Jahren zeigte sich eine signifikante Reduktion des über einen Fragebogen erhobenen Sturzrisikos bei Denosumab, jedoch nicht bei Alendronat und Zoledronat. Interessanterweise kam es nach Absetzen von Denosumab wieder zu einer signifikanten Zunahme des Sturzrisikos. Prospektive Interventionsstudien, die die Kausalität belegen könnten, liegen nicht vor, aber auch ohne diese ergibt sich zunehmend Evidenz dafür, dass sich der Einsatz von Denosumab positiv auf das Sturzrisiko auswirken kann.
Studiendaten belegen zunehmend positive Effekte einer Bisphosphonattherapie auf die Mortalität. Bereits in der Studie Zoledronat nach Hüftfraktur (Lyles K et al. 2007 📖Lyles, K. W., Colón-Emeric, C. S., Magaziner, J. S., Adachi, J. D., Pieper, C. F., Mautalen, C., … & Boonen, S. (2007). Zoledronic acid and clinical fractures and mortality after hip fracture. New England Journal of Medicine, 357(18), 1799-1809) wurde eine relative Risikosenkung der Mortalität in der Verumgruppe von 28% beobachtet. Dies wurde kritisch diskutiert, zum einen wegen der weiten Altersspanne der eingeschlossenen Patientinnen (bis 98 Jahre), zum anderen der insgesamt deutlich erhöht liegenden Mortalität nach Hüftfraktur. Diese Daten fanden Ergänzung in einer Metaanalyse zur kardiovaskulären Mortalität, Herzinfarktinzidenz und Schlaganfallinzidenz mit einer signifikanten Senkung der Mortalität in der Alendronatgruppe (1 Jahres kardiovaskuläre Mortalität HR 0.33 (0.17–0.65) p=0.001) sowie der geringeren Ereignisrate für Myokardinfarkte (HR 0.55; 95% CI, 0.33 to 0.89; p = 0.014) und Schlaganfallinzidenz(HR Jahr 5: 0.82; 95% CI, 0.67 to 1.00; p= 0.049; HR Jahr 10: 0.83; 95% CI, 0.69 to 1.01; p=0.065) (Sing CW et al. 2018 📖Sing CW, Wong AY, Kiel DP, Cheung EY, Lam JK, Cheung TT, Chan EW, Kung AW, Wong IC, Cheung CL. Association of Alendronate and Risk of Cardiovascular Events in Patients With Hip Fracture. J Bone Miner Res. 2018 Aug;33(8):1422-1434. doi: 10.1002/jbmr.3448. Epub 2018 May 9. PMID: 29744914.) als Hauptergebnis. Dieses Ergebnis zur kardiovaskulären Mortalität wird durch eine weitere Metaanalyse bestätigt (Kranenburg G et al. 2016 📖Kranenburg, G., Bartstra, J. W., Weijmans, M., de Jong, P. A., Mali, W. P., Verhaar, H. J., … & Spiering, W. (2016). Bisphosphonates for cardiovascular risk reduction: a systematic review and meta-analysis. Atherosclerosis, 252, 106-115.), wenn auch mit knapp verfehlter Signifikanz (gepooltes RR aus 10 Studien 0.81; 95% CI 0.64–1.02; I2 als Marker der Heterogenität der eingeschlossenen Studien 0%). In dieser Metaanalyse wurde zusätzlich eine verminderte Gesamt Mortalität gezeigt, jedoch bei deutlicher Heterogenität (gepooltes RR aus 48 Studien 0.90; 95% CI 0.84–0.98; I2 53%). Zudem gibt es Hinweise, dass eine Vortherapie mit Bisphosphonaten bei kritisch Erkrankten, die intensivmedizinisch betreut werden müssen, das Überleben verbessert (Mortalitätsrate Ratio 0.41, 95% CI 0.24–0.71, P < 0.01). Auch eine prospektive Studie über 5 Jahre bei Patientinnen und Patienten > 85 Jahre (Sambrook P et al. 2011 📖Pfeilschifter J, Cooper C, Watts NB, Flahive J, Saag KG, Adachi JD, Boonen S, Chapurlat R, Compston JE, Díez-Pérez A, LaCroix AZ, Netelenbos JC, Rossini M, Roux C, Sambrook PN, Silverman S, Siris ES. Regional and age-related variations in the proportions of hip fractures and major fractures among postmenopausal women: the Global Longitudinal Study of Osteoporosis in Women. Osteoporos Int. 2012; Aug;23(8):2179-88. doi: 10.1007/s00198-011-1840-6. Epub 2011 Nov 16., Evidenzgrad 2b Oxford) bestätigt diese Daten, hier wurde eine Senkung der Mortalität um 27% bei Bisphosphonateinnahme beobachtet (HR 0.73; 95% CI, 0.56 -0.94; P=0.02).
Zusammenfassend ist festzuhalten, dass bei der Aufklärung zu einer Bisphosphonattherapie neben der Aufklärung zu den potentiellen Nebenwirkungen auch die potentiellen positiven Effekte genannt werden sollten.
Werden Osteoporose-Präparate abgesetzt, geht deren osteoprotektive Wirkung zurück – dies gilt im Grundsatz für alle Präparate (Diab DL et al. 2013 📖Diab DL, Watts NB. Bisphosphonate drug holiday: who, when and how long. Ther Adv Musculoskelet Dis. 2013 Jun;5(3):107-11. doi: 10.1177/1759720X13477714. PMID: 23858334; PMCID: PMC3707342.). Ein narrativer Literaturreview aus 2021 hat die Effekte des Absetzens von Osteoporose-Präparaten auf Knochendichte, Knochenumbaumarker und Frakturrisiko zusammengefasst (Elbers LPB et al. 2021 📖Elbers LPB, Raterman HG, Lems WF. Bone Mineral Density Loss and Fracture Risk After Discontinuation of Anti-osteoporotic Drug Treatment: A Narrative Review. Drugs. 2021 Sep;81(14):1645-1655. doi: 10.1007/s40265-021-01587-x. Epub 2021 Sep 15. PMID: 34524681; PMCID: PMC8519894.). Die Abnahme der Knochendichte nach einem Jahr nach Absetzen beträgt für Alendronat und Zoledronat ca. 0,4 % (LWS und Hüfte), für Risedronat, Ibandronat und Raloxifen ca. 1-3 % (LWS und Hüfte), für Teriparatid 1,3-1,7 % an der LWS (keine Änderung an der Hüfte), für Denosumab ca. 6,5 % an der LWS und 1,9-5,3 % an der Hüfte, für Romosozumab 9,3 % an der LWS, 5,4 % Gesamtfemur und 4,4 % am Femurhals.
Alendronat und Risedronat: In der FLEX-Studie wurde randomisiert untersucht, ob Patentinnen und Patienten auch noch jenseits von 5 Jahren Alendronattherapie von der Behandlung profitieren. Unter Fortführung von Alendronat bei einer Kohorte stieg die Knochendichte an der Wirbelsäule im Vergleich zur Placebokohorte (was einem Absetzen von Alendronat nach 5 Jahren entspricht) weiter an und es kam zu signifikant weniger klinischen vertebralen Frakturen (Black DM et al. 2006 📖Black DM, Reid IR, Boonen S, Bucci-Rechtweg C, Cauley JA, Cosman F, Cummings SR, Hue TF, Lippuner K, Lakatos P, Leung PC, Man Z, Martinez RL, Tan M, Ruzycky ME, Su G, Eastell R. The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2012 Feb;27(2):243-54. doi: 10.1002/jbmr.1494. Erratum in: J Bone Miner Res. 2012 Dec;27(12):2612. PMID: 22161728; PMCID: PMC3427916. LoE 1+ SIGN). In der post-hoc Analyse zeigte sich, dass das Risiko für non-vertebrale Frakturen auch in der Gruppe ohne prävalente Wirbelkörperfrakturen signifikant niedriger war, wenn der T-Score nach 5 Jahren an der Hüfte ≤ -2,5 lag (Schwartz AV et al. 2010 📖Schwartz AV, Bauer DC, Cummings SR, Cauley JA, Ensrud KE, Palermo L, Wallace RB, Hochberg MC, Feldstein AC, Lombardi A, Black DM; FLEX Research Group. Efficacy of continued alendronate for fractures in women with and without prevalent vertebral fracture: the FLEX trial. J Bone Miner Res. 2010 May;25(5):976-82. doi: 10.1002/jbmr.11. PMID: 20200926. LoE 1+ SIGN). In einer randomisierten Studie mit 3 Jahren Risedronat zeigt sich 1 Jahr nach Therapieabbruch eine anhaltende fraktursenkende Wirkung und ein Abfall der Knochendichte, jedoch nicht auf Ausgangswerte (Watts NB et al. 2008 📖Watts NB, Chines A, Olszynski WP, McKeever CD, McClung MR, Zhou X, Grauer A. Fracture risk remains reduced one year after discontinuation of risedronate. Osteoporos Int. 2008 Mar;19(3):365-72. doi: 10.1007/s00198-007-0460-7. Epub 2007 Oct 16. PMID: 17938986.).
In einer Studie mit Zoledronat konnte nach 3 Jahren Therapie eine anhaltende Frakturwirksamkeit (morphometrische Wirbelkörperfrakturen) auch in den zweiten 3 Jahren Therapie gezeigt werden (Black DM et al. 2012 📖Black DM, Reid IR, Boonen S, Bucci-Rechtweg C, Cauley JA, Cosman F, Cummings SR, Hue TF, Lippuner K, Lakatos P, Leung PC, Man Z, Martinez RL, Tan M, Ruzycky ME, Su G, Eastell R. The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2012 Feb;27(2):243-54. doi: 10.1002/jbmr.1494. Erratum in: J Bone Miner Res. 2012 Dec;27(12):2612. PMID: 22161728; PMCID: PMC3427916. LoE 1+ SIGN).
Nach 18 Monaten Teriparatidtherapie (versus Placebo) erfolgte eine 18-monatige, entblindete Nachbeobachtung (Lindsay R et al. 2004 📖Lindsay R, Scheele WH, Neer R, Pohl G, Adami S, Mautalen C, Reginster JY, Stepan JJ, Myers SL, Mitlak BH. Sustained vertebral fracture risk reduction after withdrawal of teriparatide in postmenopausal women with osteoporosis. Arch Intern Med. 2004 Oct 11;164(18):2024-30. doi: 10.1001/archinte.164.18.2024. PMID: 15477438. LoE 1+ SIGN). Hier zeigt sich eine anhaltende fraktursenkende Wirkung vertebrale Frakturen betreffend für den ehemaligen Verumarm. In zwei randomisierten kontrollierten Studien wurde die Auswirkung der Beendigung einer Teriparatid-Behandlung auf die Knochendichte untersucht. In der EUROFORS Studie (Eastell R et al. 2009 📖Eastell R, Nickelsen T, Marin F, Barker C, Hadji P, Farrerons J, Audran M, Boonen S, Brixen K, Gomes JM, Obermayer-Pietsch B, Avramidis A, Sigurdsson G, Glüer CC. Sequential treatment of severe postmenopausal osteoporosis after teriparatide: final results of the randomized, controlled European Study of Forsteo (EUROFORS). J Bone Miner Res. 2009 Apr;24(4):726-36. doi: 10.1359/jbmr.081215. PMID: 19049337.) wurden die Patientinnen und Patienten nach 12 Monaten Teriparatidtherapie randomisiert in ein weiteres Jahr Teriparatid, ein Jahr Raloxifen oder keine aktive Behandlung. An der Wirbelsäule kam es unter Teriparatidfortsetzung zu einer weiteren Knochendichtezunahme, unter Raloxifen blieb die zugewonnene BMD unverändert und ohne aktive Therapie fiel die Knochendichte im zweiten Jahr wieder ab. In einer weiteren Studie (Adami S et al. 2008 📖Adami S, San Martin J, Muñoz-Torres M, Econs MJ, Xie L, Dalsky GP, McClung M, Felsenberg D, Brown JP, Brandi ML, Sipos A. Effect of raloxifene after recombinant teriparatide [hPTH(1-34)] treatment in postmenopausal women with osteoporosis. Osteoporos Int. 2008 Jan;19(1):87-94. doi: 10.1007/s00198-007-0485-y. Epub 2007 Oct 16. PMID: 17938984.) wurde Teriparatid ein Jahr lang verabreicht, im Anschluss erfolgte die Randomisierung zu Raloxifen oder Placebo. Auch hier zeigte sich eine Knochendichteabnahme von 2,2 % bzw. 4,4 % an der Wirbelsäule. Dies übersteigt die zu erwartete Knochenverlustrate bei unbehandelten postmenopausalen Frauen von 0,5 bis 1,0 % pro Jahr, sodass der Knochenverlust beschleunigt ist, wenn Teriparatid abgesetzt wird. Eine antiresorptive Therapie ist nach Beendigung einer Teriparatidtherapie essenziell zum Erhalt der hinzugewonnenen Knochenmasse. Unter Alendronat und Denosumab kommt es zu einem weiteren Anstieg der Knochendichte, wobei der Effekt bei Denosumab stärker ist als bei Alendronat (Niimi R et al. 2018 📖Niimi R, Kono T, Nishihara A, Hasegawa M, Kono T, Sudo A. Efficacy of Switching From Teriparatide to Bisphosphonate or Denosumab: A Prospective, Randomized, Open-Label Trial. JBMR Plus. 2018 Jun 2;2(5):289-294. doi: 10.1002/jbm4.10054. PMID: 30283910; PMCID: PMC6139701.).
Nach Absetzen von Denosumab kommt es zum massiven Abfall der Knochendichte. Der prätherapeutische Ausgangswert wurde in einer Studie mit vier Gaben Denosumab bereits 12 Monate nach Ende des letzten Therapieintervalls erreicht (Bone HG et al. 2011 📖Bone HG, Hosking D, Devogelaer JP, Tucci JR, Emkey RD, Tonino RP, Rodriguez-Portales JA, Downs RW, Gupta J, Santora AC, Liberman UA; Alendronate Phase III Osteoporosis Treatment Study Group. Ten years’ experience with alendronate for osteoporosis in postmenopausal women. N Engl J Med. 2004 Mar 18;350(12):1189-99. doi: 10.1056/NEJMoa030897. PMID: 15028823.). Ein signifikanter Unterschied zur Placebogruppe blieb jedoch erhalten, hier hatte die Knochendichte weiter abgenommen. Biochemisch zeigte sich ein überschießender Anstieg der Knochenaktivitätsmarker (CTX und P1NP) über das prätherapeutische Ausgangsniveau und die Werte der Placebogruppe hinaus – dieser Effekt wird heute international als “Reboundphänomen” bezeichnet. Nach Absetzen von Denosumab kommt es zum Wiederanstieg des Risikos für vertebrale Frakturen auf das Niveau der Placebogruppe (Cummings SR et al. 2018 📖Cummings SR, Ferrari S, Eastell R, Gilchrist N, Jensen JB, McClung M, Roux C, Törring O, Valter I, Wang AT, Brown JP. Vertebral Fractures After Discontinuation of Denosumab: A Post Hoc Analysis of the Randomized Placebo-Controlled FREEDOM Trial and Its Extension. J Bone Miner Res. 2018 Feb;33(2):190-198. doi: 10.1002/jbmr.3337. Epub 2017 Nov 22. PMID: 29105841.). Betrachtet man den Anteil multipler Wirbelkörperfrakturen an allen Wirbelkörperfrakturen pro Gruppe, dann ist der Anteil mit 61 % in der Gruppe, die Denosumab abgesetzt haben, signifikant höher als in der Gruppe, die immer nur Placebo erhalten hatte (39 %). In einer großen Fragebogenstudie aus der Schweiz mit 797 Patientinnen und Patienten unter Real-Welt-Bedingungen zeigte sich ein Anstieg vertebraler Frakturen von 0,75 % pro Jahr während Therapie auf 4,1 % pro Jahr nach Absetzen der Therapie (Burckhardt P et al. 2021 📖Burckhardt P, Faouzi M, Buclin T, Lamy O; The Swiss Denosumab Study Group. Fractures After Denosumab Discontinuation: A Retrospective Study of 797 Cases. J Bone Miner Res. 2021 Sep;36(9):1717-1728. doi: 10.1002/jbmr.4335. Epub 2021 May 19. PMID: 34009703; PMCID: PMC8518625.). Zur Beendigung von Denosumab wurde von der ECTS im Jahr 2017 ein systematischer Review und Position Statement publiziert, das 2020 aktualisiert wurde (EPub ahead of print) und klare Handlungsempfehlungen gibt (Tsourdi E et al. 2017 📖Tsourdi E, Langdahl B, Cohen-Solal M, Aubry-Rozier B, Eriksen EF, Guañabens N, Obermayer-Pietsch B, Ralston SH, Eastell R, Zillikens MC. Discontinuation of Denosumab therapy for osteoporosis: A systematic review and position statement by ECTS. Bone. 2017 Dec;105:11-17. doi: 10.1016/j.bone.2017.08.003. Epub 2017 Aug 5. PMID: 28789921., Tsourdi E et al. 2021 📖Tsourdi E, Zillikens MC, Meier C, Body JJ, Gonzalez Rodriguez E, Anastasilakis AD, Abrahamsen B, McCloskey E, Hofbauer LC, Guañabens N, Obermayer-Pietsch B, Ralston SH, Eastell R, Pepe J, Palermo A, Langdahl B. Fracture risk and management of discontinuation of denosumab therapy: a systematic review and position statement by ECTS. J Clin Endocrinol Metab. 2020 Oct 26:dgaa756. doi: 10.1210/clinem/dgaa756. Epub ahead of print. PMID: 33103722.). Als Anschlusstherapie wird eine Behandlung mit Zoledronat empfohlen. Nach kurzer Therapiedauer (bis 2,5 Jahre) und bei niedrigem Risiko wird eine Therapie mit 1-2 Gaben Zoledronat 5mg i. v. in Abhängigkeit von Knochendichteverlauf und Knochenumbaumarkern empfohlen. Ist die Gabe von Zoledronat nicht möglich, so kann alternativ Alendronat in dieser kurzen Therapiedauergruppe zur Anwendung kommen (Tsourdi E et al 2017 📖Tsourdi E, Langdahl B, Cohen-Solal M, Aubry-Rozier B, Eriksen EF, Guañabens N, Obermayer-Pietsch B, Ralston SH, Eastell R, Zillikens MC. Discontinuation of Denosumab therapy for osteoporosis: A systematic review and position statement by ECTS. Bone. 2017 Dec;105:11-17. doi: 10.1016/j.bone.2017.08.003. Epub 2017 Aug 5. PMID: 28789921.[/mfn, Tsourdi E et al. 2021 📖Tsourdi E, Zillikens MC, Meier C, Body JJ, Gonzalez Rodriguez E, Anastasilakis AD, Abrahamsen B, McCloskey E, Hofbauer LC, Guañabens N, Obermayer-Pietsch B, Ralston SH, Eastell R, Pepe J, Palermo A, Langdahl B. Fracture risk and management of discontinuation of denosumab therapy: a systematic review and position statement by ECTS. J Clin Endocrinol Metab. 2020 Oct 26:dgaa756. doi: 10.1210/clinem/dgaa756. Epub ahead of print. PMID: 33103722.). Wichtig ist gerade bei oralen Bisphosphonaten in dieser Situation den Knochenstoffwechsel durch Knochenumbauparameterkontrollen 3 und 6 Monate nach Switch der Therapie zu monitorieren. Nur bei kurzer Therapiedauer von Denosumab und Nichtverfügbarkeit von Zoledronat soll eine orale Bisphosphonat-Therapie über 1-2 Jahre zum Einsatz kommen. Für die Patientinnen und Patienten mit längerer Therapiedauer und höherem Risiko wird eine Erstgabe von Zoledronat am Ende des Denosumab-Intervalls empfohlen. Dann sollen die Knochenumbaumarker nach 3 und 6 Monaten kontrolliert werden. Bei Anstieg von CTX über 0,280 ng/ml oder P1NP über 35 µg/L soll die zweite Zoledronatinfusion schon entsprechend früher erfolgen. Wenn keine Knochenumbaumarker verfügbar sind, wird eine Gabe von Zoledronat 6 und 12 Monate nach letzter Denosumabgabe empfohlen.. In der erwähnten Schweizer Fragebogenstudie ergab sich durch eine Bisphosphonat-Anschlusstherapie eine Hazard Ratio für das Auftreten vertebraler Frakturen von 0,042, für das Auftreten multipler vertebraler Frakturen von 0,06 (Burckhardt P et al. 2021 📖Burckhardt P, Faouzi M, Buclin T, Lamy O; The Swiss Denosumab Study Group. Fractures After Denosumab Discontinuation: A Retrospective Study of 797 Cases. J Bone Miner Res. 2021 Sep;36(9):1717-1728. doi: 10.1002/jbmr.4335. Epub 2021 May 19. PMID: 34009703; PMCID: PMC8518625.). Besonders gefährdet für einen Rebound sind Patientinnen und Patienten mit prävalenter Wirbelkörperfraktur, proximaler Femurfraktur der Eltern und mit hohen Knochenumbaumarkern nach Absetzen von Denosumab, während eine Bisphosphonat-Vortherapie das Risiko mindert (Burckhardt P et al. 2021 📖Burckhardt P, Faouzi M, Buclin T, Lamy O; The Swiss Denosumab Study Group. Fractures After Denosumab Discontinuation: A Retrospective Study of 797 Cases. J Bone Miner Res. 2021 Sep;36(9):1717-1728. doi: 10.1002/jbmr.4335. Epub 2021 May 19. PMID: 34009703; PMCID: PMC8518625.).
Nach 24 Monaten Romosozumab-Therapie kommt es nach Absetzen rasch innerhalb von 12 Monaten zum Abfall der zugewonnen Knochendichte auf Werte knapp über dem prätherapeutischen Niveau sowohl an der Hüfte als auch an der Wirbelsäule (McClung MR et al. 2018 📖McClung MR. Romosozumab for the treatment of osteoporosis. Osteoporos Sarcopenia. 2018 Mar;4(1):11-15. doi: 10.1016/j.afos.2018.03.002. Epub 2018 Mar 27. PMID: 30775535; PMCID: PMC6362945.). Dies liegt über den Messwerten der Placebogruppe, die in der Studienphase Knochendichte verloren hatte. Biochemisch zeigt sich bereits unter Therapie ein Abfall des P1NP auf Ausgangs-/Placeboniveau. CTX steigt nach Absetzen von Romosozumab überschießend auf Werte oberhalb des Ausgangsniveaus an. In den Zulassungsstudien für Romosozumab erfolgte nach 12 Monaten Therapie eine Anschlusstherapie mit Alendronat (70 mg p. o. pro Woche) in der Kohorte mit moderatem Risiko (Saag KG et al. 2017 📖Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-1427. doi: 10.1056/NEJMoa1708322. Epub 2017 Sep 11. PMID: 28892457. LoE 2) und mit Denosumab in der Kohorte mit hohem Risiko (Cosman F et al. 2016 📖Cosman F, Crittenden DB, Adachi JD, Binkley N, Czerwinski E, Ferrari S, Hofbauer LC, Lau E, Lewiecki EM, Miyauchi A, Zerbini CA, Milmont CE, Chen L, Maddox J, Meisner PD, Libanati C, Grauer A. Romosozumab Treatment in Postmenopausal Women with Osteoporosis. N Engl J Med. 2016 Oct 20;375(16):1532-1543. doi: 10.1056/NEJMoa1607948. Epub 2016 Sep 18. PMID: 27641143. LoE 2).
| Empfehlung | |
|
Bei Beendigung einer Romosozumab-, Teriparatid- oder Denosumabtherapie soll am Ende des jeweiligen Therapieintervalls (Romosozumab 1 Monat, Teriparatid 1 Tag, Denosumab 6 Monate) der vorangegangenen Therapie eine antiresorptive Anschlusstherapie erfolgen.
|
Empfehlungsgrad A |
| Evidenzgrad 2 |
|
| Konsensstärke 19 von 19 Starker Konsens |
|
| Belegende Evidenzen:
Eastell R, Nickelsen T, Marin F, Barker C, Hadji P, Farrerons J, Audran M, Boonen S, Brixen K, Gomes JM, Obermayer-Pietsch B, Avramidis A, Sigurdsson G, Glüer CC. Sequential treatment of severe postmenopausal osteoporosis after teriparatide: final results of the randomized, controlled European Study of Forsteo (EUROFORS). J Bone Miner Res. 2009 Apr;24(4):726-36. doi: 10.1359/jbmr.081215. PMID: 19049337. LoE 2 Burckhardt P, Faouzi M, Buclin T, Lamy O; The Swiss Denosumab Study Group. Fractures After Denosumab Discontinuation: A Retrospective Study of 797 Cases. J Bone Miner Res. 2021 Sep;36(9):1717-1728. doi: 10.1002/jbmr.4335. Epub 2021 May 19. PMID: 34009703; PMCID: PMC8518625. LoE 3 Tsourdi E, Zillikens MC, Meier C, Body JJ, Gonzalez Rodriguez E, Anastasilakis AD, Abrahamsen B, McCloskey E, Hofbauer LC, Guañabens N, Obermayer-Pietsch B, Ralston SH, Eastell R, Pepe J, Palermo A, Langdahl B. Fracture risk and management of discontinuation of denosumab therapy: a systematic review and position statement by ECTS. J Clin Endocrinol Metab. 2020 Oct 26:dgaa756. doi: 10.1210/clinem/dgaa756. Epub ahead of print. PMID: 33103722. LoE 4 Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-1427. doi: 10.1056/NEJMoa1708322. Epub 2017 Sep 11. PMID: 28892457. LoE 2 Cosman F, Crittenden DB, Adachi JD, Binkley N, Czerwinski E, Ferrari S, Hofbauer LC, Lau E, Lewiecki EM, Miyauchi A, Zerbini CA, Milmont CE, Chen L, Maddox J, Meisner PD, Libanati C, Grauer A. Romosozumab Treatment in Postmenopausal Women with Osteoporosis. N Engl J Med. 2016 Oct 20;375(16):1532-1543. doi: 10.1056/NEJMoa1607948. Epub 2016 Sep 18. PMID: 27641143. LoE 2 |
|
Für Bisphosphonate gibt es als einzige Substanzgruppe Daten zu einer möglichen Therapiepause. Die European Menopause and Andropause Society (EMAS) hat 2017 ein Positionspapier veröffentlicht zur Therapiepause unter Bisphosphonat-Therapie (Anagnostis P et al. 2017 📖Anagnostis P, Paschou SA, Mintziori G, Ceausu I, Depypere H, Lambrinoudaki I, Mueck A, Pérez-López FR, Rees M, Senturk LM, Simoncini T, Stevenson JC, Stute P, Trémollieres FA, Goulis DG. Drug holidays from bisphosphonates and denosumab in postmenopausal osteoporosis: EMAS position statement. Maturitas. 2017 Jul;101:23-30. doi: 10.1016/j.maturitas.2017.04.008. Epub 2017 Apr 15. PMID: 28539165. LoE 3). Hier wird eine Evaluation bzgl. Therapiepause nach mehr als 5 Jahren Alendronat oder 3 Jahren Zoledronat empfohlen. Eine Therapiepause kann individuell erwogen werden, wenn vor und während der Therapie keine Frakturen aufgetreten sind und das berechnete Frakturrisiko gering ist. In einem klinischen Review wird empfohlen, eine Therapiepause von Bisphosphonaten bei niedrigem Frakturrisiko (10-Jahres-Frakturrisko <10 % für major osteoporotic fractures) durchzuführen und bei Patientinnen und Patienten mit moderatem Frakturrisiko (10-20 %) in Erwägung zu ziehen, wenn keine Wirbelkörperfrakturen vorliegen (aktuelles Röntgen LWS/BWS) und wenn keine anderen Fragilitätsfrakturen vorliegen und wenn der T-Score am Femurhals >-2,5 liegt (Brown JP et al. 2014). Dies entspricht den Empfehlungen der Task Force der American Society for Bone and Mineral Research (Adler RA et al. 2016 📖Adler RA, Hastings FW, Petkov VI. Treatment thresholds for osteoporosis in men on androgen deprivation therapy: T-score versus FRAX. Osteoporos Int. 2010; Apr;21(4):647- 53. doi: 10.1007/s00198-009-0984-0. Epub 2009 Jun 17. Evidenzgrad 3b Oxford) und basiert auf den Verlängerungsstudien der Zulassungsstudien für Alendronat und Zoledronat, die zeigen konnten, dass die Fortführung von Alendronat jenseits der 5 Jahre und Zoledronat jenseits der 3 Jahre zu einer signifikanten Reduktion vertebraler Frakturen führt im Vergleich zum Switch zu Placebo. Nur die Niedrigrisikogruppen mit einem T-Score an der Hüfte > -2,5 und ohne weitere Risikofaktoren hatten keine Frakturrisikoreduktion mehr in der Verlängerungsphase (Schwartz AV et al. 2010 📖Schwartz AV, Bauer DC, Cummings SR, Cauley JA, Ensrud KE, Palermo L, Wallace RB, Hochberg MC, Feldstein AC, Lombardi A, Black DM; FLEX Research Group. Efficacy of continued alendronate for fractures in women with and without prevalent vertebral fracture: the FLEX trial. J Bone Miner Res. 2010 May;25(5):976-82. doi: 10.1002/jbmr.11. PMID: 20200926. LoE 1+ SIGN). Auch ein aktueller systematischer Review mit Metaanalyse der Studiendaten (Nayak A et al. 2019) bestätigt diese Strategie: Insgesamt muss jedoch angemerkt werden, dass keine prospektiv randomisierten Studien zur Frage der Therapiepause von Bisphosphonaten existieren und dass auch ein aktueller systematischer Review dieses hohe Maß an Unsicherheit betont (Marchand D et al. 2019, LoE 1 📖Marchand D, Loshak H. Duration of Bisphosphonate Treatment for Patients with Osteoporosis: A Review of Clinical Effectiveness and Guidelines [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2019 Oct 4. PMID: 31893493. LoE 1).
| Empfehlung | |
|
Unter spezifischer Osteoporose-Therapie sollten regelmäßig das Frakturrisiko, der belegte Nutzen der Therapie, das Nebenwirkungsrisiko und die Gesamtsituation reevaluiert werden.
|
Empfehlungsgrad B |
| Evidenzgrad 4 |
|
| Konsensstärke 19 von 19 Starker Konsens |
|
| Empfehlung | |
|
Bei Abfall des Risikos unter die DVO-Therapieschwelle sollte – insbesondere nach Bisphosphonat-Therapie – eine Therapiepause empfohlen werden.
|
Empfehlungsgrad B |
| Evidenzgrad 2 |
|
| Konsensstärke 19 von 19 Starker Konsens |
|
| Belegende Evidenzen:
Anagnostis P, Paschou SA, Gkekas NN, Artzouchaltzi AM, Christou K, Stogiannou D, Vryonidou A, Potoupnis M, Goulis DG. Efficacy of anti-osteoporotic medications in patients with type 1 and 2 diabetes mellitus: a systematic review. Endocrine. 2018 Jun;60(3):373-383. doi: 10.1007/s12020-018-1548-x. Epub 2018 Feb 6. PMID: 29411304. LoE 1 Schwartz AV, Bauer DC, Cummings SR, Cauley JA, Ensrud KE, Palermo L, Wallace RB, Hochberg MC, Feldstein AC, Lombardi A, Black DM; FLEX Research Group. Efficacy of continued alendronate for fractures in women with and without prevalent vertebral fracture: the FLEX trial. J Bone Miner Res. 2010 May;25(5):976-82. doi: 10.1002/jbmr.11. PMID: 20200926. LoE 1+ SIGN Nayak S, Greenspan SL. A systematic review and meta-analysis of the effect of bisphosphonate drug holidays on bone mineral density and osteoporotic fracture risk. Osteoporos Int. 2019 Apr;30(4):705-720. doi: 10.1007/s00198-018-4791-3. Epub 2019 Jan 8. PMID: 30623214; PMCID: PMC6499675. LoE 2 Marchand D, Loshak H. Duration of Bisphosphonate Treatment for Patients with Osteoporosis: A Review of Clinical Effectiveness and Guidelines [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2019 Oct 4. PMID: 31893493. LoE 1 |
|
| Empfehlung | |
|
Bei anhaltend hohem Frakturrisiko oberhalb der DVO-Therapieschwelle sollte eine Fortführung der bisherigen Therapie oder ein Wechsel des Therapieprinzips empfohlen werden.
|
Empfehlungsgrad B |
| Evidenzgrad 2 |
|
| Konsensstärke 19 von 19 Starker Konsens |
|
| Belegende Evidenzen:
Anagnostis P, Paschou SA, Mintziori G, Ceausu I, Depypere H, Lambrinoudaki I, Mueck A, Pérez-López FR, Rees M, Senturk LM, Simoncini T, Stevenson JC, Stute P, Trémollieres FA, Goulis DG. Drug holidays from bisphosphonates and denosumab in postmenopausal osteoporosis: EMAS position statement. Maturitas. 2017 Jul;101:23-30. doi: 10.1016/j.maturitas.2017.04.008. Epub 2017 Apr 15. PMID: 28539165. LoE 3 Schwartz AV, Bauer DC, Cummings SR, Cauley JA, Ensrud KE, Palermo L, Wallace RB, Hochberg MC, Feldstein AC, Lombardi A, Black DM; FLEX Research Group. Efficacy of continued alendronate for fractures in women with and without prevalent vertebral fracture: the FLEX trial. J Bone Miner Res. 2010 May;25(5):976-82. doi: 10.1002/jbmr.11. PMID: 20200926. LoE 1+ SIGN Nayak S, Greenspan SL. A systematic review and meta-analysis of the effect of bisphosphonate drug holidays on bone mineral density and osteoporotic fracture risk. Osteoporos Int. 2019 Apr;30(4):705-720. doi: 10.1007/s00198-018-4791-3. Epub 2019 Jan 8. PMID: 30623214; PMCID: PMC6499675. LoE 2 Marchand D, Loshak H. Duration of Bisphosphonate Treatment for Patients with Osteoporosis: A Review of Clinical Effectiveness and Guidelines [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2019 Oct 4. PMID: 31893493. LoE 1 |
|
Auf Basis der beschriebenen Evidenz kann wie folgt zusammengefasst werden: Für die beiden osteoanabolen Präparate Teriparatid und Romosozumab konnte bei Patientinnen und Patienten mit hohem Frakturrisiko in randomisierten Studien eine Überlegenheit gegenüber oralen Bisphosphonaten mit Frakturendpunktdaten belegt werden. In der Hochrisikosituation (Bspw. nach Wirbelkörperfraktur oder proximaler Femurfraktur) soll daher als Erstlinientherapie primär eine osteoanabole Therapie erwogen werden. Zu beachten ist, dass die Vortherapie Einfluss auf die osteoanabole Wirkung (gemessen am Zuwachs der Knochendichte) von Romosozumab (Ebina K et al. 2021) hat. So war der Knochendichtezuwachs an der LWS ohne Vortherapie bei 18,2 %, nach Bisphosphonat-Therapie bei 10,2 %, nach Teriparatid-Therapie bei 11,2 % und nach Denosumab-Therapie bei nur 6,4 %. Nach Denosumab-Vortherapie konnte am Gesamtfemur kein signifikanter Knochendichtezuwachs durch Romosozumab erreicht werden. Für Teriparatid zeigte sich in der VERO-Studie kein Einfluss der Vortherapie auf die fraktursenkende Wirkung. In der DATA-Switch-Studie zeigte sich jedoch, dass bezüglich der Knochendichte die Sequenz Teriparatid-Denosumab signifikant höhere Knochendichtezugewinne erbrachte als die Sequenz Denosumab-Teriparatid (Leder BZ et al. 2015 📖Leder BZ, Tsai JN, Uihlein AV, Wallace PM, Lee H, Neer RM, Burnett-Bowie SA. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): extension of a randomised controlled trial. Lancet. 2015 Sep 19;386(9999):1147-55. doi: 10.1016/S0140-6736(15)61120-5. Epub 2015 Jul 2. PMID: 26144908; PMCID: PMC4620731. LoE SIGN 1++.).
| Empfehlung | |
|
Liegen die Voraussetzungen für eine osteoanabole Therapie vor, dann sollte die individuelle Therapiesequenz mit einer osteoanabolen Therapie begonnen werden.
|
Empfehlungsgrad B |
| Evidenzgrad 2 |
|
| Konsensstärke 19 von 19 Starker Konsens |
|
| Belegende Evidenzen:
Leder BZ, Tsai JN, Uihlein AV, Wallace PM, Lee H, Neer RM, Burnett-Bowie SA. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): extension of a randomised controlled trial. Lancet. 2015 Sep 19;386(9999):1147-55. doi: 10.1016/S0140-6736(15)61120-5. Epub 2015 Jul 2. PMID: 26144908; PMCID: PMC4620731. LoE SIGN 1++ Ebina K, Tsuboi H, Nagayama Y, Kashii M, Kaneshiro S, Miyama A, Nakaya H, Kunugiza Y, Hirao M, Okamura G, Etani Y, Takami K, Goshima A, Miura T, Nakata K, Okada S. Effects of prior osteoporosis treatment on 12-month treatment response of romosozumab in patients with postmenopausal osteoporosis. Joint Bone Spine. 2021 Oct;88(5):105219. doi: 10.1016/j.jbspin.2021.105219. Epub 2021 May 19. PMID: 34020048. LoE 4 Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, Maddox J, Fan M, Meisner PD, Grauer A. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-1427. doi: 10.1056/NEJMoa1708322. Epub 2017 Sep 11. PMID: 28892457. LoE 2 Kendler DL, Marin F, Zerbini CAF, Russo LA, Greenspan SL, Zikan V, Bagur A, Malouf-Sierra J, Lakatos P, Fahrleitner-Pammer A, Lespessailles E, Minisola S, Body JJ, Geusens P, Möricke R, López-Romero P. Effects of teriparatide and risedronate on new fractures in post-menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018 Jan 20;391(10117):230-240. doi: 10.1016/S0140-6736(17)32137-2. Epub 2017 Nov 9. Erratum in: Lancet. 2017 Nov 30;: Erratum in: Lancet. 2018 Dec 1;392(10162):2352. PMID: 29129436. LoE 2 |
|
Aus den obigen Ausführungen ergibt sich folgendes praktisches Vorgehen bei Einleitung einer Osteoporose-Therapie:
Das Monitoring einer Osteoporose-Therapie ist schwierig, da bis heute kein eindeutig messbares Therapieziel definiert ist. Angesichts der Auswirkungen einer Osteoporose-bedingten Fraktur auf Morbidität und Mortalität können in Ermangelung eines definierten Therapieziels Surrogatparameter des Knochenstoffwechsels (Knochendichte und Knochenumbauparameter) zur Beurteilung des Effektes einer Therapie monitoriert und Daten zur Prädiktion von Frakturen berücksichtigt werden. Die Verhinderung der Fraktur entspricht dem Haupttherapieziel.
Wie bereits in der Leitlinie 2017 mit starkem Konsens empfohlen, sollten nach Einleitung einer spezifischen Therapie klinische Kontrollen zunächst alle 3-6 Monate erfolgen. Bei den Kontrolluntersuchungen sollten die folgenden Punkte überprüft werden:
Ggf. sollten entsprechende Maßnahmen (Anpassung der Medikation z. B. bei Niereninsuffizienz; radiologische Diagnostik bei Verdacht auf neue Fraktur) veranlasst werden.
Treten im Verlauf – außerhalb der geplanten Kontrolluntersuchungen – Änderungen des Frakturrisikos auf, wie z. B. Frakturen oder die Aufnahme einer systemischen Glucocorticoid-Therapie, sollte dies zu einer Überprüfung des Frakturrisikos und ggf. zu einer Therapieänderung führen.
Knochendichtemessungen innerhalb der ersten 5 Jahre nach Therapieinitiierung waren in der MANITOBA Studie (Leslie WD et al. 2019 📖Leslie WD, Lix LM; for the Manitoba Bone Density Program. Absolute fracture risk assessment using lumbar spine and femoral neck bone density measurements: Derivation and validation of a hybrid system. J Bone Miner Res. 2011; Mar;26(3):460-7. doi: 10.1002/jbmr.248. Evidenzgrad 2b Oxford.) mit einer verbesserten Frakturrisikosenkung und Medikamentenadhärenz verbunden. Nach dem Matching der Kohorten wurden 4.599 Frauen mit BMD-Verlaufsmessung (mittleres Intervall der BMD Messung 3,2 ± 0,9 Jahre) und 4.599 Frauen ohne BMD-Verlaufsmessung verglichen. Die Hazard Ratios (HRs) für Frakturen lag bei Frauen in der monitorierten Gruppe signifikant niedriger im Vergleich zu nicht monitorierten Frauen hinsichtlich Major osteoporotic Frakturen (HR = 0,89) und Hüftfrakturen (HR = 0,74). Die Anzahl der Tage, an denen Medikamente eingenommen wurden, das Verhältnis zur Medikamentenpersistenz und der Wechsel der Behandlung über 5 Jahre waren höher bei Frauen in der monitorierten Gruppe. Dies lag auch daran, dass eine ungünstige Knochendichteveränderung im Verlauf öfter als in der nicht monitorierten Gruppe zu einem Therapiewechsel führte.
In einer Metaregression (Bouxsein ML et al. 2019 📖Bouxsein ML, Eastell R, Lui LY, Wu LA, de Papp AE, Grauer A, Marin F, Cauley JA, Bauer DC, Black DM; FNIH Bone Quality Project. Change in Bone Density and Reduction in Fracture Risk: A Meta-Regression of Published Trials. J Bone Miner Res. 2019 Apr;34(4):632-642. doi: 10.1002/jbmr.3641. Epub 2019 Jan 23. PMID: 30674078. LoE 1) aus 38 placebokontrollierten Studien mit 19 verschiedenen Therapieansätzen konnte zudem gezeigt werden, dass das Ausmaß der Knochendichtezuwächse mit dem Ausmaß der Frakturrisikoreduktion assoziiert ist. Die Hauptlimitation des Ansatzes einer Metaregression zu verschiedenen Therapiestudien ist jedoch im Poolen verschiedener Therapieansätze und Therapiedauern zu sehen.
Zusammenfassend liegen Hinweise für einen Zusatznutzen einer Knochendichtemessung nach Therapieinitiierung vor. Zu beachten ist, dass unter antiresorptiver Therapie, vor allem bei oralen Bisphosphonaten und SERMs, ein Nichtanstieg der Knochendichte kein Hinweis für eine verminderte frakturreduzierende Wirkung ist.
| Empfehlung | |
|
Nach Beginn/Wechsel einer Osteoporose-Therapie sollte vor Ablauf von 5 Jahren eine Knochendichte-Verlaufskontrolle durchgeführt werden.
|
Empfehlungsgrad B |
| Evidenzgrad 2 |
|
| Konsensstärke 15/2/2 (19) Konsens |
|
| Sondervotum der DEGAM: kann statt sollte
Begründung: O. g. Studie von Leslie zeigte nur Assoziationen und die Übertragbarkeit auf andere Gesundheitssysteme ist unklar. Diese Messungen sind auch nicht Kassenleistung* und stellen eine – wenn auch geringe – zusätzliche Strahlenbelastung dar. Die vorhandenen Kapazitäten sollten vorrangig für die Erkennung von Hochrisiko-Patientinnen und -Patienten sowie geteilte Entscheidungsfindung und Unterstützung bei der Adhärenz (siehe vorausgegangene Kapitel) eingesetzt werden. |
|
Für orale und intravenöse Bisphosphonate sowie Raloxifen konnte in einer gepoolten Meta-Regression (Bauer DC et al. 2018 📖Bauer DC, Black DM, Bouxsein ML, Lui LY, Cauley JA, de Papp AE, Grauer A, Khosla S, McCulloch CE, Eastell R; Foundation for the National Institutes of Health (FNIH) Bone Quality Project. Treatment-Related Changes in Bone Turnover and Fracture Risk Reduction in Clinical Trials of Anti-Resorptive Drugs: A Meta-Regression. J Bone Miner Res. 2018 Apr;33(4):634-642. doi: 10.1002/jbmr.3355. Epub 2018 Jan 10. PMID: 29318649. LoE 2) von Daten auf individueller Ebene aus 14 Studien gezeigt werden, dass mit der Kontrolle von Knochenumbaumarkern 3-12 Monate nach Therapiebeginn das Ausmaß der Frakturreduktion hinsichtlich vertebraler Frakturen vorhergesagt werden kann. Dies galt insbesondere für die Bestimmung von Knochenspezifischer Alkalischer Phosphatase (BAP) und Prokollagen Typ 1-N-terminales Propeptid (P1NP): Extrapoliert sagte in der Studie eine 12%ige Nettoverringerung der BAP eine 33%ige Verringerung des Wirbelkörperfrakturrisikos voraus, eine 30%ige Nettoverringerung der BAP eine 65%ige Verringerung des Wirbelfrakturrisikos. Eine 22%ige Nettoreduktion von P1NP sagte eine 30%ige Reduktion des Wirbelfrakturrisikos voraus, eine 50%ige Nettoreduktion von P1NP eine 62%ige Reduktion des Wirbelfrakturrisikos. Für Hüftfrakturen und non-vertebrale Frakturen waren die Effekte nicht signifikant. Zu Zoledronat (Bell KJ et al. 2016 📖Bell KJ, Hayen A, Glasziou P, Irwig L, Eastell R, Harrison SL, Black DM, Bauer DC. Potential Usefulness of BMD and Bone Turnover Monitoring of Zoledronic Acid Therapy Among Women With Osteoporosis: Secondary Analysis of Randomized Controlled Trial Data. J Bone Miner Res. 2016 Sep;31(9):1767-73. doi: 10.1002/jbmr.2847. Epub 2016 Apr 25. PMID: 27027655. LoE 2) liegen zudem Hinweise für eine Prädiktion klinischer Frakturen durch P1NP vor. Bezüglich des Knochenresorptionsmarkes CTX liegen die Ergebnisse der RCT (der Zulassungsstudien sowie diverser weiterer Studien) von allen in der DVO-Leitlinie empfohlenen spezifischen medikamentösen Osteoporose-Therapien vor, die eine entsprechende Veränderung nach 3 Monaten der Therapie aufzeigen. Angesichts der Daten der zitierten Metaanalyse zu den Knochenumbauparametern wird eine Kontrolle des Knochenabbauparameters CTX auf Basis der Daten aus den Zulassungsstudien und mit Verweis auf die notwendige Standardisierung der Probenentnahme analog zu der Kontrolle von P1NP und BAP zur Effektivität der antiresorptiven Therapie gesehen.
Für Knochenumbaumarker unter osteoanaboler Therapie liegen keine neuen Studiendaten vor.
| Empfehlung | |
|
Es kann erwogen werden, das Ergebnis von Knochenumbaumarkern bei Beginn einer antiresorptiven Therapie sowie nach 3-12 Monaten zur Vorhersage der zu erwartenden Wirbelkörperfrakturreduktion heranzuziehen.
|
Empfehlungsgrad 0 |
| Evidenzgrad 2 |
|
| Konsensstärke 16 von 16 Starker Konsens |
|
| Belegende Evidenzen:
Bauer DC, Black DM, Bouxsein ML, Lui LY, Cauley JA, de Papp AE, Grauer A, Khosla S, McCulloch CE, Eastell R; Foundation for the National Institutes of Health (FNIH) Bone Quality Project. Treatment-Related Changes in Bone Turnover and Fracture Risk Reduction in Clinical Trials of Anti-Resorptive Drugs: A Meta-Regression. J Bone Miner Res. 2018 Apr;33(4):634-642. doi: 10.1002/jbmr.3355. Epub 2018 Jan 10. PMID: 29318649. LoE 2 Bell KJ, Hayen A, Glasziou P, Irwig L, Eastell R, Harrison SL, Black DM, Bauer DC. Potential Usefulness of BMD and Bone Turnover Monitoring of Zoledronic Acid Therapy Among Women With Osteoporosis: Secondary Analysis of Randomized Controlled Trial Data. J Bone Miner Res. 2016 Sep;31(9):1767-73. doi: 10.1002/jbmr.2847. Epub 2016 Apr 25. PMID: 27027655. LoE 2 |
|
Es gibt keine evaluierten Kriterien für ein medikamentöses Therapieversagen. Ein Therapieversagen – mit der Konsequenz der Prüfung der Gründe (z. B. schlechte Adhärenz oder Resorption, Änderung der Risikokonstellation) und ggf. der Umstellung auf eine andere Medikation – ist zu erwägen:
Der Nutzen eines Therapiewechsels ohne Hinweis auf ein Therapieversagen ist in Bezug auf eine Reduktion der Frakturrate nicht belegt.
Im Allgemeinen führt das Absetzen aller Osteoporose-Therapien zu einer Knochendichteabnahme und einem raschen Anstieg der Knochenumbaumarker innerhalb des ersten Jahres nach Beendigung einer antiresorptiven Therapie, Ausnahmen sind Alendronat und Zoledronat. Für eine Knochendichtemessung am proximalen Femur ergaben sich nach einem Jahr keine Änderungen für Teriparatid, eine Verringerung von unter 1 % für Alendronat und Zoledronat und eine Verringerung von über 2 % für Denosumab und Romosozumab (Elbers LPB et al. 2021 📖Elbers, L. P., Raterman, H. G., & Lems, W. F. (2021). Bone mineral density loss and fracture risk after discontinuation of anti-osteoporotic drug treatment: a narrative review. Drugs, 81(14), 1645-1655. ). Die Evidenz zur Veränderung der Surrogatparameter Knochendichte und Knochenumbauparameter fasst dieser narrative Review zu den Follow-Up-Studien der randomisiert kontrollierten Studien zusammen. Hierbei gab es nur wenige Daten zum Frakturrisiko nach Absetzen der Therapie.
| Empfehlung | |
|
Eine Kontrolle von Knochenumbauparametern und/oder der Knochendichte mittels DXA sollte nach Absetzen einer spezifischen Osteoporose-Therapie erwogen werden.
|
Empfehlungsgrad B |
| Evidenzgrad Expertenkonsens |
|
| Konsensstärke 19 von 19 Starker Konsens |
|
| Belegende Evidenz:
Elbers LPB, Raterman HG, Lems WF. Bone Mineral Density Loss and Fracture Risk After Discontinuation of Anti-osteoporotic Drug Treatment: A Narrative Review. Drugs. 2021 Sep;81(14):1645-1655. doi: 10.1007/s40265-021-01587-x. Epub 2021 Sep 15. PMID: 34524681; PMCID: PMC8519894. |
|
| Empfehlung | |
|
Nach niedrig-traumatischen, stabilen Wirbelkörperfrakturen soll schnellstmöglich eine Mobilisierung erfolgen.
|
Empfehlungsgrad A |
| Evidenzgrad 2 |
|
| Konsensstärke 16/16 Starker Konsens |
|
| Belegende Evidenz:
Cha KH, Cho TG, Kim CH, Lee HK, Moon JG. Korean J Spine. 2013 Sep;10(3):144-8. LoE SIGN 2+ |
|
Daten aus einer prospektiven und 2 retrospektiven koreanischen Studien zeigen, dass eine verlängerte Bettruhephase (7 Tage oder mehr) im Vergleich zu einer frühzeitigeren Mobilisation das Risiko für Folgekomplikationen der Immobilität, wie Pneumonie, Thromboembolien und funktionelle Verluste, erhöht (Cha K et al. 2013, Cho S et al. 2022, Kim G et al. 2022 📖Cho ST, Kim SJ, Nam BJ, Kim KW, Lee GH, Kim JH. Asian Spine J. 2022 Dec;16(6):898-905. ). Gleichzeitig blieben Komplikationen früherer Mobilisation, wie eine Verschlechterung des Frakturstatus, aus. Daraus kann geschlussfolgert werden, dass schnellstmöglich eine Mobilisierung bei niedrigtraumatischen und stabilen Wirbelkörperfrakturen erfolgen soll.
| Empfehlung | |
|
Zur Behandlung von Frakturschmerzen sollen NSAR, Paracetamol, Metamizol und Opiate unter Beachtung des WHO-Stufenschema, und des Nutzen-Risikoprofils jeder einzelnen Substanz individuell empfohlen werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 |
|
| Konsensstärke 16/16 Starker Konsens |
|
| Belegende Evidenz:
Rzewuska, M. et al. The efficacy of conservative treatment of osteoporotic compression fractures on acute pain relief: a systematic review with meta-analysis. Eur Spine J. 24. 702-14. 2015 SIGN 1++ |
|
Es existieren keine qualitativ hochwertigen Studien zur Wirksamkeit von Schmerzmitteln speziell bei Patientinnen und Patienten mit osteoporotischen Frakturen. Allerdings gibt es gute Evidenz für diese Schmerzmittel bei muskuloskelettalen Schmerzen. Deswegen wird auf die Publikationen zum WHO-Stufenschema und auf Empfehlungen deutscher und internationaler Schmerzgesellschaften verwiesen (Rzewuska M et al 2015 📖Rzewuska, M. et al. The efficacy of conservative treatment of osteoporotic compression fractures on acute pain relief: a systematic review with meta-analysis. Eur Spine J. 24. 702-14. 2015 SIGN 1++, Vellucci R et al. 2018 📖Vellucci R, Terenzi R, Kanis JA, Kress HG, Mediati RD, Reginster JY, Rizzoli R, Brandi ML. Understanding osteoporotic pain and its pharmacological treatment Osteoporos Int. 2018 Jul;29(7):1477-1491.). Vom WHO-Stufenschema muss in vielen Fällen wegen Kontraindikationen oder nicht tolerabler Nebenwirkungen abgewichen werden. Da meist ältere Menschen behandelt werden, sind die Regeln der “Schmerztherapie beim älteren Menschen” anzuwenden mit Berücksichtigung von Komorbiditäten, Nebenwirkungen und Komedikationen. Opiate und Sedativa sind mit einer erhöhten Sturzrate und einem erhöhten Risiko für Hüftfrakturen verbunden. Siehe Kapitel Risikofaktoren 4. Für die längerfristige Schmerztherapie wird auf die Hinweise der LONTS-Leitlinie (Häuser W et al. 2020 📖Häuser W, Bock F, Hüppe M, Nothacker M, Norda H, Radbruch L, Schiltenwolf M, Schuler M, Tölle T, Viniol A, Petzke F; Koautoren für die Konsensusgruppe der 2. Aktualisierung der S3-Leitlinie LONTS. Schmerz. 2020 Jun;34(3):204-244.) verwiesen.
Eine (schwache) analgetische Wirkung von Bisphosphonaten nach Wirbelkörperfrakturen ist nur bei intravenöser Hochdosistherapie nachgewiesen, nicht aber für die üblicherweise in der Osteoporose-Therapie verwendeten Dosen. Für osteoporoseübliche Dosierungen der Bisphosphonate und für andere frakturreduzierende Osteoporosetherapeutika, wie z. B. Teriparatid, ist im Langzeitverlauf eine Reduktion der Frequenz von Rückenschmerzen belegt, wobei dies vermutlich über die Reduktion neuer vertebraler Frakturen erklärbar ist (Armingeat T et al. 2006 📖Armingeat T, Brondino R, Pham T, Legre V, Lafforgue P. Intravenous pamidronate for pain relief in recent osteoporotic vertebral compression fracture: a randomized double-blind controlled study. Osteoporos Int. 2006; Nov;17(11):1659-65. Evidenzgrad 1++ SIGN, Gangij V et al. 1999 📖Gangij V, Appelboom T. Analgesic Effect of Intravenous Pamidronate on chronic back pain due to osteoporotic vertebral fractures. Clin Rheumatol. 1999; 18: 266-267. Evidenzgrad 3 SIGN, Nevitt M et al. 2006 📖Nevitt-MC, Chen-P, Dore-RK, Reginster-JY, Kiel-DP, Zanchetta-JR, Glass-EV, Krege- JH. Reduced risk of back pain following teriparatide treatment: a meta-analysis. Osteoporos Int. 2006; 17: 273-280. Evidenzgrad 1++ SIGN, Papadokostakis G et al. 2005 📖Papadokostakis-G, Katonis-P, Damilakis-J, Hadjipavlou-A. Does raloxifene treatment influence back pain and disability among postmenopausal women with osteoporosis. Eur Spine J. 2005; 14: 977-981. ).
| Empfehlung | |
|
Supervidierte Übungsprogramme mit oder ohne Patientenedukation sollen Patientinnen und Patienten mit Osteoporose angeboten werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz:
Hoffmann I, Shojaa M, Kohl M, von Stengel S, Becker C, Gosch M, Jakob F, Kerschan-Schindl K, Kladny B, Clausen J, Lange U, Middeldorf S, Peters S, Schoene D, Sieber C, Tholen R, Thomasius F, Bischoff-Ferrari HA, Uder M, Kemmler W. Exercise Reduces the Number of Overall and Major Osteoporotic Fractures in Adults. Does Supervision Make a Difference? Systematic Review and Meta-Analysis. J Bone Miner Res. 2022 Nov;37(11):2132-2148 LoE 2 |
|
Supervidierte Übungsprogramme, z. B. im Rahmen von Physiotherapie, Rehasport, Funktionstraining, ambulanter Rehabilitation oder ähnlichen Programmen, können Schmerzen reduzieren, die Lebensqualität verbessern, zu einer Verbesserung der Knochendichte führen sowie Stürze und sturzbedingten Frakturen reduzieren (Hoffmann et al. 2022 📖Hoffmann I, Shojaa M, Kohl M, von Stengel S, Becker C, Gosch M, Jakob F, Kerschan-Schindl K, Kladny B, Clausen J, Lange U, Middeldorf S, Peters S, Schoene D, Sieber C, Tholen R, Thomasius F, Bischoff-Ferrari HA, Uder M, Kemmler W. Exercise Reduces the Number of Overall and Major Osteoporotic Fractures in Adults. Does Supervision Make a Difference? Systematic Review and Meta-Analysis. J Bone Miner Res. 2022 Nov;37(11):2132-2148). Die Literatur hierzu ist heterogen aufgrund der verschiedenen Interventionen und Unterschieden in Trainingshäufigkeit, Intensität, Länge der Trainingsperiode und der Nachbeobachtung und Supervision. Zusätzlich besteht Variabilität in den untersuchten Zielparametern (Hoffmann I et al. 2023 📖Hoffmann I, Kohl M, von Stengel S, Jakob F, Kerschan-Schindl K, Lange U, Peters S, Schoene D, Sieber C, Thomasius F, Bischoff-Ferrari HA, Uder M, Kemmler W. Exercise and the prevention of major osteoporotic fractures in adults: a systematic review and meta-analysis with special emphasis on intensity progression and study duration. Osteoporos Int. 2023 Jan;34(1):15-28., Gibbs J et al. 2019 📖J. C. Gibbs, N. J. MacIntyre, M. Ponzano, J. A. Templeton, L. Thabane, A. Papaioannou, et al. Exercise for improving outcomes after osteoporotic vertebral fracture. Cochrane Database Syst Rev 2019 Vol. 7 Pages CD008618, Pinto D et al. 2022 📖Pinto, D., Alshahrani, M., Chapurlat, R., Chevalley, T., Dennison, E., Camargos, B. M., … & Bruyère, O. (2022). The global approach to rehabilitation following an osteoporotic fragility fracture: A review of the rehabilitation working group of the International Osteoporosis Foundation (IOF) committee of scientific advisors. Osteoporos Int. 2022 Mar;33(3):527-540. doi: 10.1007/s00198-021-06240-7, Shojaa et al. 2020 📖Shojaa, von Stengel, Kohl, Schoene, Kemmler (2020): Effects of dynamic resistance exercise on bone mineral density in postmenopausal women: a systematic review and meta-analysis with special emphasis on exercise parameters. Osteoporosis International 31:1427–1444 https://doi.org/10.1007/s00198-020-05441-w ). Vor diesem Hintergrund sind Ergebnisse von Metaanalysen differenziert zu betrachten. Wichtig ist, dass die Übungsprogramme eine ausreichende Intensität und Dauer haben und verschiedene Übungsformen miteinander kombinieren.
Hierzu sollten Kraft- und Gleichgewichtstrainingskomponenten gehören, die mehrfach pro Woche ausgeführt werden sollten. Das Training sollte individuell auf den Leistungszustand angepasst werden, überschwellig zu einem reinen Erhaltungsreiz sein und progressiv in seiner Intensität sein, um einen optimalen Effekt zu haben (Hoffmann I et al. 2023 📖Hoffmann I, Kohl M, von Stengel S, Jakob F, Kerschan-Schindl K, Lange U, Peters S, Schoene D, Sieber C, Thomasius F, Bischoff-Ferrari HA, Uder M, Kemmler W. Exercise and the prevention of major osteoporotic fractures in adults: a systematic review and meta-analysis with special emphasis on intensity progression and study duration. Osteoporos Int. 2023 Jan;34(1):15-28.). Positive Ergebnisse können sowohl mit als auch ohne zusätzlicher Patientenedukation erzielt werden. Das Training kann im Rahmen von Selbsthilfegruppen, Funktionstraining, Rehasport und Krankengymnastik erfolgen.
| Empfehlung | |
|
Sind trotz der Anwendung von ambulanten konservativen Behandlungsmöglichkeiten Schmerzen und Funktions-beeinträchtigungen nicht beherrschbar, sollte eine multimodale stationäre Behandlung durchgeführt werden.
|
Empfehlungsgrad B |
| Evidenzgrad 1 |
|
| Konsensstärke 18/18 Starker Konsens |
|
| Belegende Evidenz:
H. H. Handoll, I. D. Cameron, J. C. Mak, C. E. Panagoda and T. P. Finnegan. Multidisciplinary rehabilitation for older people with hip fractures. Cochrane Database Syst Rev 2021 Vol. 11 Pages CD007125 LoE 1 |
|
Im Anschluss an osteoporotische Frakturen, oder daraus resultierende chronische Schmerzsyndrome und Funktionsverluste, können rehabilitative Interventionen zu einer Besserung der Alltagsfunktion, Mobilität und Lebensqualität führen, das Sturzrisiko und die Sturzangst reduzieren und die Chance, in vorherige Lebensverhältnisse zurückzukehren, verbessern (Handoll H et al. 2021 📖Handoll, H. H., Cameron, I. D., Mak, J. C., Panagoda, C. E., & Finnegan, T. P. (2021). Multidisciplinary rehabilitation for older people with hip fractures. Cochrane Database of Systematic Reviews, (11).). In der Literatur findet sich Evidenz, dass sowohl ambulante bzw. Heim-basierte wie auch (teil-) stationäre Rehabilitationsprogramme effektiv sind (Handoll H et al. 2021 📖Handoll, H. H., Cameron, I. D., Mak, J. C., Panagoda, C. E., & Finnegan, T. P. (2021). Multidisciplinary rehabilitation for older people with hip fractures. Cochrane Database of Systematic Reviews, (11)., Bachmann S et al. 2010 📖Bachmann S, Finger C, Huss A, Egger M, Stuck AE, Clough-Gorr KM. Inpatient rehabilitation specifically designed for geriatric patients: systematic review and meta-analysis of randomised controlled trials. BMJ. 2010; Apr 20;340:c1718. doi: 10.1136/bmj.c1718., Smith T et al. 2020 📖T. O. Smith, A. W. Gilbert, A. Sreekanta, O. Sahota, X. L. Griffin, J. L. Cross, et al. Enhanced rehabilitation and care models for adults with dementia following hip fracture surgery. Cochrane Database Syst Rev 2020 Vol. 2 Pages CD010569, Talevski J et al. 2019 📖Talevski J, Sanders KM, Duque G, Connaughton C, Beauchamp A, Green D, Millar L, Brennan-Olsen SL. Effect of Clinical Care Pathways on Quality of Life and Physical Function After Fragility Fracture: A Meta-analysis. J Am Med Dir Assoc. 2019 Jul;20(7):926.e1-926.e11. doi: 10.1016/j.jamda.2019.02.022. Epub 2019 Apr 8. PMID: 30975586., Wu J et al. 2018 📖Wu J Effect of home-based rehabilitation for hip fracture: A meta-analysis of randomized controlled trials. Rehabil Med 2018; 50: 481–486). Falls eine ambulante Behandlung nicht möglich ist oder Schmerzen oder Funktionsbeeinträchtigungen unter ambulanten Behandlungen nicht beherrschbar sind, sollte eine multimodale stationäre Behandlung erwogen werden. In einer solchen Behandlung können Komponenten wie Physiotherapie, Ergotherapie, Hilfsmittelversorgung, Ernährungsberatung, Patientenedukation, psychologische Gespräche und Anpassung der Medikation enthalten sein (Pinto D et al. 2022 📖Pinto, D., Alshahrani, M., Chapurlat, R., Chevalley, T., Dennison, E., Camargos, B. M., … & Bruyère, O. (2022). The global approach to rehabilitation following an osteoporotic fragility fracture: A review of the rehabilitation working group of the International Osteoporosis Foundation (IOF) committee of scientific advisors. Osteoporos Int. 2022 Mar;33(3):527-540. doi: 10.1007/s00198-021-06240-7, Singh N et al. 2012 📖Singh NA, Quine S, Clemson LM, Williams EJ, Williamson DA, Stavrinos TM, Grady JN, Perry TJ, Lloyd BD, Smith EU, Singh MA. Effects of high-intensity progressive resistance training and targeted multidisciplinary treatment of frailty on mortality and nursing home admissions after hip fracture: a randomized controlled trial. J Am Med Dir Assoc. 2012; Jan;13(1):24-30. doi: 10.1016/j.jamda.2011.08.005. ). Dies gilt auch für an Demenz Erkrankte.
| Empfehlung | |
|
Osteoporose-Selbsthilfegruppen und Rehasportgruppen sollen Osteoporose-Patientinnen und -Patienten empfohlen werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 |
|
| Konsensstärke 17/17 Starker Konsens |
|
| Belegende Evidenz:
Rubæk M, Hitz MF, Holmberg T, Schønwandt BMT, Andersen S. Effectiveness of patient education for patients with osteoporosis: a systematic review. Osteoporos Int. 2022 May;33(5):959-977. doi: 10.1007/s00198-021-06226-5. Epub 2021 Nov 12. PMID: 34773131. LoE 1 |
|
An Osteoporose Erkrankte erfahren körperliche und psychische Konsequenzen durch die Diagnose der Osteoporose und osteoporotische Frakturen. Hierzu gehören unter anderen Verlust von Körpergröße, Hyperkyphose der Wirbelsäule und Funktionsverlust, aber auch Depression, Angst, Unsicherheit, Stigmatisierung und Schuld. Studien zeigen, dass Osteoporose-Patientinnen und -Patienten sich bessere Edukation und Unterstützung durch strukturierte Programme wünschen (Rubaek M et al. 2022 📖Rubæk M, Hitz MF, Holmberg T, Schønwandt BMT, Andersen S. Effectiveness of patient education for patients with osteoporosis: a systematic review. Osteoporos Int. 2022 May;33(5):959-977. doi: 10.1007/s00198-021-06226-5. Epub 2021 Nov 12. PMID: 34773131.). Der Anschluss an eine Selbsthilfe- bzw. Rehasportgruppe bietet eine langfristige Unterstützungsmöglichkeit. Edukation und Austausch innerhalb von Selbsthilfegruppen verbessern das Wissen über Osteoporose und die Adhärenz zu Osteoporose-Medikamenten (Cornelissen D et al. 2020 📖Cornelissen D, de Kunder S, Si L, Reginster JY, Evers S, Boonen A, Hiligsmann M; European Society for Clinical and Economic Aspect of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Interventions to improve adherence to anti-osteoporosis medications: an updated systematic review. Osteoporos Int. 2020 Sep;31(9):1645-1669. doi: 10.1007/s00198-020-05378-0. Epub 2020 May 1. PMID: 32358684; PMCID: PMC7423788., Morfeld J et al. 2017 📖Morfeld JC, Vennedey V, Müller D, Pieper D, Stock S. Patient education in osteoporosis prevention: a systematic review focusing on methodological quality of randomised controlled trials. Osteoporos Int. 2017 Jun;28(6):1779-1803. doi: 10.1007/s00198-017-3946-y. Epub 2017 Feb 24. PMID: 28236127., Shorey S et al. 2021 📖S. Shorey and V. Chan. Women Living With Osteoporosis: A Meta-Synthesis. Gerontologist 2021 Vol. 61 Issue 3 Pages e39-e47). Rehasportgruppen führen zu Verbesserung der motorischen Fähigkeiten und Kenntnis über die eigene Belastbarkeit. Beide Arten von Gruppen dienen der besseren Krankheitsbewältigung. Mittlerweile gibt es mehrere systematische Reviews, die den Effekt von Patientenedukation von Osteoporose-Patientinnen und -Patienten auf Lebensqualität, psychosoziale Funktion, Schmerz, körperliche Aktivität, Osteoporose-Wissen und Adhärenz bei Osteoporose-Medikamenten und Calcium- und Vitamin D-Einnahme untersuchen. Auch wenn die Ergebnisse heterogen und nicht immer signifikant sind, zeigt sich aber dennoch, dass diese Programme einen positiven Einfluss auf die erwähnten Parameter haben (Saito M et al. 2018 📖Saito M, Moore-Lotridge SN, Uppuganti S, Egawa S, Yoshii T, Robinette JP, Posey SL, Gibson BHY, Cole HA, Hawley GD, Guelcher SA, Tanner SB, McCarthy JR, Nyman JS, Schoenecker JG. Determining the pharmacologic window of bisphosphonates that mitigates severe injury-induced osteoporosis and muscle calcification, while preserving fracture repair. Osteoporos Int. 2022 Apr;33(4):807-820. doi: 10.1007/s00198-021-06208-7. Epub 2021 Oct 31. PMID: 34719727., Nielsen D et al. 2010 📖Nielsen, D., Ryg, J., Nielsen, W., Knold, B., Nissen, N., & Brixen, K. (2010). Patient education in groups increases knowledge of osteoporosis and adherence to treatment: a two-year randomized controlled trial. Patient education and counseling, 81(2), 155-160., Cornelissen D et al. 2020 📖Cornelissen D, de Kunder S, Si L, Reginster JY, Evers S, Boonen A, Hiligsmann M; European Society for Clinical and Economic Aspect of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Interventions to improve adherence to anti-osteoporosis medications: an updated systematic review. Osteoporos Int. 2020 Sep;31(9):1645-1669. doi: 10.1007/s00198-020-05378-0. Epub 2020 May 1. PMID: 32358684; PMCID: PMC7423788.).
| Empfehlung | |
|
Um eine schmerzarme Mobilisation zu ermöglichen, kann die Versorgung mit einer wirbelsäulenaufrichtenden Orthese erwogen werden.
|
Empfehlungsgrad 0 |
| Evidenzgrad 1 |
|
| Konsensstärke 18/18 Starker Konsens |
|
| Belegende Evidenz:
Jin, Y. Z., & Lee, J. H. (2016). Effect of brace to osteoporotic vertebral fracture: a meta-analysis. Journal of Korean medical science, 31(10), 1641-1649. OXFORD LoE 1 |
|
| Empfehlung | |
|
Die Orthesen sollten mit physiotherapeutischen Übungsprogrammen und Haltungsschulungen zur Anwendung kommen.
|
Empfehlungsgrad B |
| Evidenzgrad 1 |
|
| Konsensstärke 19/19 Starker Konsens |
|
| Belegende Evidenz:
Jin, Y. Z., & Lee, J. H. (2016). Effect of brace to osteoporotic vertebral fracture: a meta-analysis. Journal of Korean medical science, 31(10), 1641-1649. OXFORD LoE 1 |
|
Rückenorthesen werden eingesetzt, um Schmerzen nach osteoporotischen Wirbelkörperfrakturen zu reduzieren, eine verbesserte Körperhaltung zu erreichen und die Alltagsfunktion zu verbessern (Hettchen M et al. 2022 📖Hettchen M, Willert S, von Stengel S, Kohl M, Kemmler W. Effects of the “Spinomed active” orthosis on chronic back pain in kyphotic women with osteoporotic vertebral fractures three months and older: A randomized controlled study. Front Pain Res (Lausanne). 2022 Dec 21;3:1038269. doi: 10.3389/fpain.2022.1038269. PMID: 36618579; PMCID: PMC9811681., Sanchez-Pinto B et al 2022 📖Sánchez-Pinto-Pinto B, Romero-Morales C, López-López D, de-Labra C, García-Pérez-de-Sevilla G. Efficacy of Bracing on Thoracic Kyphotic Angle and Functionality in Women with Osteoporosis: A Systematic Review. Medicina (Kaunas). 2022 May 24;58(6):693. doi: 10.3390/medicina58060693. PMID: 35743956; PMCID: PMC9228437.). So kann eine Reduktion der durch Frakturen entstandenen Hyperkyphose das Gleichgewicht und die Funktion der Rumpfmuskulatur verbessern, was wiederum zu einer Schmerzreduktion führen kann (Hofler R et al. 2020 📖R. C. Hofler and G. A. Jones. Bracing for Acute and Subacute Osteoporotic Compression Fractures: A Systematic Review of the Literature. World Neurosurg 2020 Vol. 141 Pages e453-e460, Goodwin V et al. 2016 📖V. A. Goodwin, A. J. Hall, E. Rogers and A. Bethel. Orthotics and taping in the management of vertebral fractures in people with osteoporosis: a systematic review. BMJ Open 2016 Vol. 6 Issue 5 Pages e010657, Newman M et al. 2016 📖Newman, M. et al. Spinal Orthoses for Vertebral Osteoporosis an Osteoporotic Vertebral Fracture: A Systematic Review. Arch Phys Med Rehabil. 97. 1013-25. 2016. ). Einzelne Orthesen sind bei identischem Design nicht explizit anderen überlegen; tendenziell sind semirigide, flexible Orthesen (thorako-lumbale Orthesen, TLOs) zu erwägen, wobei es keine Vergleichsstudien zu Orthesen gibt.
Evidenz liegt aus randomisierten Studien und systematischen Analysen zur Schmerzreduktion und zur Funktionsverbesserung durch Orthesen vor. Positive Effekte durch eine semirigide Orthese (thorakolumbale Orthese, TLO) auf die Muskelkraft der Rückenstrecker und auf die Abdominalmuskulatur wurden beschrieben (Pfeifer M et al. 2017 📖M. Pfeifer, M. Gehlen and C. Hinz. [Spinal orthoses in the treatment of vertebral fractures with osteoporosis : A systematic review article]. Z Rheumatol 2017 Vol. 76 Issue 10 Pages 860-868).
Die Aufklärung der Patientin/des Patienten durch den Arzt über die Indikation, den Tragemodus (einschleichende Behandlung bis zu 2 Std./Tag), sowie die korrekte Anpassung der Orthese und Kontrolle während der Behandlungszeit durch den Orthopädietechniker sind erforderlich.
| Empfehlung | |
|
Elektrische Feldtherapie und Elektrotherapie, wie Interferenzstrom und horizontale Therapie mit und ohne Übungsprogramm, können zur Schmerzreduktion bei multiplen Wirbelkörperfrakturen und zur Funktionsverbesserung erwogen werden.
|
Empfehlungsgrad 0 |
| Evidenzgrad 2 |
|
| Konsensstärke 18/18 Starker Konsens |
|
| Belegende Evidenz:
Zambito A, Bianchini D, Gatti D, Rossini M, Adami S, Viapiana O. Interferential and horizontal therapies in chronic low back pain due to multiple vertebral fractures: a randomized, double blind, clinical study, Osteoporos Int 2007;18(11):1541-5. SIGN 1 |
|
Kleine randomisierte Studien zeigen, dass elektrische Feldtherapie/Elektrotherapie bei Patientinnen und Patienten mit Wirbelkörperfrakturen zu einer Verbesserung von Schmerzen und Funktion führen können (Zambito A et al. 2006 📖Zambito A, Bianchini D, Gatti D, Viapiana O, Rossini M, Adami S. Interferential and horizontal therapies in chronic low back pain: a randomized, double blind, clinical study. Clin Exp Rheumatol 2006;24(5):534-9, 2007 📖Zambito A, Bianchini D, Gatti D, Rossini M, Adami S, Viapiana O. Interferential and horizontal therapies in chronic low back pain due to multiple vertebral fractures: a randomized, double blind, clinical study, Osteoporos Int 2007;18(11):1541-5., Rossini M et al. 2010 📖Rossini M, Viapiana O, Gatti D, de Terlizzi F, Adami S, Capacitively coupled electric field for pain relief in patients with vertebral fractures and chronic pain. Clin Orthop Relat Res 2010;468(3):735-40.).
| Empfehlung | |
|
Kyphoplastie und Vertebroplastie können frühzeitig erwogen werden, wenn eine nicht-operative konservative Therapie keine ausreichende Schmerzlinderung gebracht hat oder die Schmerzen die Lebensqualität der Patientinnen und Patienten erheblich beeinträchtigen. Dies betrifft insbesondere Patientinnen und Patienten mit: |
Empfehlungsgrad 0 |
| Evidenzgrad 1 |
|
| Konsensstärke 18/18 Starker KonsensEine Enthaltung wegen Interessenkonflikt |
|
| Belegende Evidenz:
Rodriguez, A. J., Fink, H. A., Mirigian, L., Guañabens, N., Eastell, R., Akesson, K., … & Ebeling, P. R. (2017). Pain, quality of life, and safety outcomes of kyphoplasty for vertebral compression fractures: report of a task force of the American Society for Bone and Mineral Research. Journal of Bone and Mineral Research, 32(9), 1935-1944. OXFORD LoE 1 |
|
Die perkutane Wirbelkörperaugmentation mithilfe von Vertebroplastie oder Kyphoplastie ist ein sicheres, wirksames und dauerhaftes Verfahren bei geeigneten Patientinnen und Patienten mit symptomatischen osteoporotischen Wirbelkörperfrakturen. Diese Verfahren sollen erwogen werden, wenn eine nichtoperative konservative Therapie keine ausreichende Schmerzlinderung innerhalb der ersten 2 bis 6 Wochen nach Fraktur erbracht hat oder die Schmerzen die Lebensqualität und die Mobilität der Patientin/des Patienten erheblich beeinträchtigen.
Zentren, die die Verfahren der Kyphoplastie oder Vertebroplastie anwenden, sollten diese nur in Erwägung ziehen wie in der Empfehlung genannt:
nach dokumentierter interdisziplinärer Einzelfalldiskussion und positivem MRT für eine frische Fraktur (Knochenmarködem).
Die Placebowirkung einer Scheinoperation wird im letzten Cochrane Review (Buchbinder R et al. 2018 📖Buchbinder R, Johnston RV, Rischin KJ, et al. Percutaneous vertebroplasty for osteoporotic vertebral compression fracture. Cochrane Database Syst Rev. 2018 Apr 4;4:CD006349. Evidenzlevel OXFORD 1.) mit dem Ergebnis analysiert, dass die Vertebroplastie bei der Behandlung akuter oder subakuter osteoporotischer Wirbelfrakturen in der Routinepraxis im Vergleich zu einem Scheineingriff keinen nennenswerten Nutzen in Bezug auf Schmerzen, Behinderung, Lebensqualität oder Behandlungserfolg hat. Die Schmerzreduktion ist jedoch im Vergleich zu konservativem Vorgehen, gemeint ist kein Eingriff aber Schmerztherapie, ausreichend belegt (Clark W et al. 2020 📖Clark, William, et al. “Cochrane vertebroplasty review misrepresented evidence for vertebroplasty with early intervention in severely affected patients.” BMJ evidence-based medicine 25.3 (2020): 85-89., Rodriguez A et al. 2017 📖Rodriguez AJ, Fink HA, Mirigian L, et al. Pain, quality of life and safety outcomes of kyphoplasty for vertebral compression fractures: report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2017 Sep;32(9):1935-1944. Evidenzlevel OXFORD 1, Pourtaheri S et al. 2018 📖Pourtaheri S, Luo W, Cui C, Garfin S. Vertebral augmentation is superior to nonoperative care at reducing lower back pain for symptomatic osteoporotic compression fractures: a meta-analysis. Clin Spine Surg. 2018 Oct;31(8):339-344. Evidenzlevel OXFORD 2, Xie L et al. 2017 📖Xie, L., Zhao, Z. G., Zhang, S. J., & Hu, Y. B. (2017). Percutaneous vertebroplasty versus conservative treatment for osteoporotic vertebral compression fractures: An updated meta-analysis of prospective randomized controlled trials. International Journal of Surgery, 47, 25-32. Evidenzlevel OXFORD 1, Zhang H et al. 2017 📖Zhang H, Xu C, Zhang T, et al. Does percutaneous vertebroplasty or balloon kyphoplasty for osteoporotic vertebral compression fractures increase the incidence of new vertebral fractures? A meta-analysis. Pain Physician. 2017 Jan-Feb;20(1):E13-E28. Evidenzlevel OXFORD 2).
Die Nutzen-Risiko-Bewertung der Eingriffsarten ist zu berücksichtigen, hierunter die Risiken asymptomatischer pulmonaler Zementembolien sowie Leckage bei Verwendung dünnflüssigen Zementes, Komplikationen durch Narkose oder schwere Adverse Events wie Osteomyelitis.
Der Eingriff Wirbelkörperaugmentation erhöht im Vergleich zur konservativen Behandlung nicht die Häufigkeit des Auftretens neuer Wirbelfrakturen in den angrenzenden Ebenen (Fan B et al. 2016 📖Fan, B. et al. Does vertebral augmentation lead to an increasing incidence of adjacent vertebral failure? A systematic review and meta-analysis. Int J Surg. 36. 369-376. 2016. Evidenzlevel OXFORD 1). Wichtig ist die Einleitung einer spezifischen Osteoporose-Therapie zur Senkung des Frakturrisikos. Die Indikation zur Einleitung einer spezifischen Osteoporose-Therapie zur Senkung des Frakturrisikos ist durch den Frakturstatus gegeben. Die Evidenz hierfür ergibt sich aus den Zulassungsstudien der zur medikamentösen Therapie zugelassen Medikamente, die alle die Reduktion von Wirbelkörperfrakturen als primäres Endziel hatten. Siehe Kapitel Indikation zur Therapie und Kapitel Medikamentöse Therapie.
Wirbelkörperaugmentationen nicht frakturierter Wirbel sollen nicht zur Prophylaxe erfolgen, dies i. S. der Nutzen-Risiko-Abwägung des Eingriffes und dem fehlenden Nachweis einer Frakturprävention durch präventive Augmentation (Chen Z et al. 2021 📖Chen, Z., Song, C., Lin, H. et al. Does prophylactic vertebral augmentation reduce the refracture rate in osteoporotic vertebral fracture patients: a meta-analysis. Eur Spine J30, 2691–2697 (2021)).
| Empfehlung | |
|
Nach einer Vertebroplastie oder Kyphoplastie, wie bei jeder osteoporotischen Wirbelkörperfraktur, soll eine spezifische anti-osteoporotische Therapie eingeleitet oder eine bestehende überprüft werden.
|
Empfehlungsgrad A |
| Evidenzgrad 1 |
|
| Konsensstärke 19/19 Starker Konsens |
|
| Belegende Evidenz:
Rodriguez, A. J., Fink, H. A., Mirigian, L., Guañabens, N., Eastell, R., Akesson, K., … & Ebeling, P. R. (2017). Pain, quality of life, and safety outcomes of kyphoplasty for vertebral compression fractures: report of a task force of the American Society for Bone and Mineral Research. Journal of Bone and Mineral Research, 32(9), 1935-1944.OXFORD LoE 1 Ebeling, P.R., Akesson, K., Bauer, D.C., Buchbinder, R., Eastell, R., Fink, H.A., Giangregorio, L., Guanabens, N., Kado, D., Kallmes, D., Katzman, W., Rodriguez, A., Wermers, R., Wilson, H.A. and Bouxsein, M.L. (2019), The Efficacy and Safety of Vertebral Augmentation: A Second ASBMR Task Force Report. J Bone Miner Res, 34: 3-21. Keine Bewertung nach OXFORD möglich |
|
| Empfehlung | |
|
Wirbelkörperaugmentationen nicht frakturierter Wirbelkörper sollen nicht zur Prophylaxe von Frakturen erfolgen.
|
Empfehlungsgrad A |
| Evidenzgrad 3 Chen Z. Eur Spine J. 2021 Sep;30(9):2691-2697. |
|
| Konsensstärke 19/19 Starker Konsens |
|
| Belegende Evidenz:
Chen, Z., Song, C., Lin, H. et al. Does prophylactic vertebral augmentation reduce the refracture rate in osteoporotic vertebral fracture patients: a meta-analysis. Eur Spine J30, 2691–2697 (2021) OXFORD LoE 3 |
|
Neben der konservativen Versorgung und der Versorgung durch Kyphoplastie/Vertebroplastie gibt es auch Situationen, in denen eine operative Versorgung von Wirbelkörperfrakturen erforderlich ist. Um die Indikation zur chirurgischen Intervention besser stellen zu können, wurden verschiedene Frakturklassifikationen entwickelt. An dieser Stelle sei auf die Klassifikation und daraus folgenden Therapiemöglichkeiten der Arbeitsgemeinschaft „Osteoporotische Frakturen“ der Sektion Wirbelsäule der Deutschen Gesellschaft für Orthopädie und Unfallchirurgie e.V. (DGOU) verwiesen.